| 1)胃酸分泌とヒスタミン |
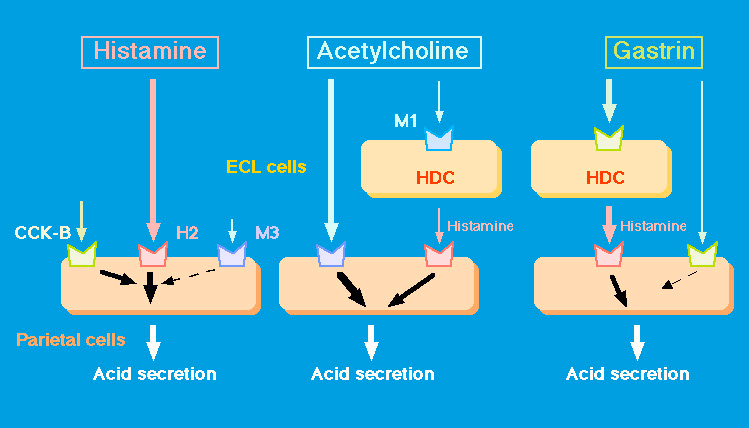
| ヒスタミンの主要な作用の一つとして胃酸分泌の促進作用が知られています。H2 受容体拮抗薬は優れた胃酸分泌抑制作用を有することから、消化性潰瘍や逆流性食道炎の治療に現在も汎用されています。酸分泌刺激因子としては様々なものが報告されていますが、ヒスタミン、ガストリン、ムスカリン神経系(アセチルコリン)は中でも重要な調節因子であると考えられています。それらの刺激因子の作用機構に関しては数多くの報告が行われていますが、相互の関係を解明することは困難でした。例えば、生体内ではガストリン刺激により常に二次的にヒスタミン遊離、合成が促進されるため、ガストリン自身に酸分泌刺激作用があるかどうかを個体レベルで明らかにすることは不可能です。近年、ガストリン、あるいはその受容体である CCK-B 受容体欠損マウスが作製されましたが、ガストリンは胃酸分泌だけではなく胃粘膜の形成過程においても重要な機能を有するため、これらのマウスでは酸分泌機能そのもの(すなわち壁細胞の機能)に障害が観察されています。H2 受容体を介するヒスタミンの作用は、拮抗薬の効果からも推測されるように胃酸分泌において決定的な作用を持つと考えられます。そこでヒスタミン合成能を欠くマウスを作製することにより、他の酸分泌刺激因子とヒスタミンとの関係を明らかにすることを目的として、ヒスチジン脱炭酸酵素 (HDC) 欠損マウスを作製しました。欠損マウス作製では HDC の補酵素であるビタミン B6 結合配列を標的として、その領域を含むエクソンを置換することにより作製しました(文献)。欠損マウスでは組織中のヒスタミン合成は検出されませんでしたが、ホモマウスは正常な発育を示し、ホモマウス同士の交配も可能でした。 |
| 2)欠損マウスの胃粘膜組織 |
|
ガストリン欠損マウス、あるいはその受容体である CCK-B 受容体欠損マウスでは胃粘膜構造に顕著な変化が見られることが報告されています。これはガストリンの有する細胞増殖因子としての作用、および粘膜形成における作用が失われることにより、正常な粘膜形成が行われないためであると考えられます。また H2 受容体欠損マウスでは壁細胞の小型化、細胞増殖の亢進が観察され、週令数を経るに従い胃が大型化し粘膜に空胞形成が観察されています。HDC 欠損マウスでは8週齢の時点での胃湿重量、および胃粘膜構造はほぼ正常で、壁細胞(抗 H, K-ATPase 染色により同定)、Enterochromaffin-like (ECL) 細胞(抗 Chromogranin A 染色により同定、野生型では HDC 発現細胞)の数、分布は野生型マウスと比較して変化ありませんでした。 |
| 3)欠損マウスにおける基礎酸分泌、血中ガストリン濃度 |
| HDC 欠損マウスの基礎分泌をウレタン麻酔下、フィストラ法で得られた分泌液を酸滴定して測定したところ、欠損マウスでは野生型と比較して若干ですが有意に低い基礎分泌が観察されました。しかしながら全くの無酸状態ではないことから、欠損マウスでは他の酸分泌刺激経路がある程度代償的に作用していることが推察されました。また 24 時間絶食時の血中ガストリン濃度は野生型の約 3 倍で高ガストリン血症を示すことが明らかとなりました。血中ガストリン濃度は胃内 pH の変化に応じて変動することから、これは欠損マウスにおける胃内 pH の上昇に対応するものと考えられます。実際、欠損マウスにヒスタミンを皮内投与すると顕著な酸分泌が観察されますが、この時(投与 30 分後)血中ガストリン濃度は投与前の約 50 % に減少することが確認されました。 |
| 4)欠損マウスにおける刺激に応じた酸分泌 |
1.ヒスタミンによる酸分泌 |
| 5)胃における酸分泌関連遺伝子の発現 |
|
胃における酸分泌に関連する遺伝子の発現を Northern blot により検討しました。その結果、H,
K-ATPase (proton pump)、H2、M3、CCK-B 受容体、ガストリンといった遺伝子の発現は野生型と欠損マウスで全く変化は見られませんでした。さらにイムノブロットによる検討を行いましたが、H,
K-ATPase の発現量は変化がありませんでした。一方、H2 受容体が共役する G タンパク質である Gs の発現量は欠損マウスで有意に亢進していました。これは
H2 アンタゴニストあるいは H, K-ATPase 阻害剤の長期投与を中断した際に見られるリバウンドモデルによる結果と一致しており、H2
受容体を介したシグナル伝達機構が増強されている可能性を示唆するものです。 |
| 考察 |
|
HDC 欠損マウスを用いることにより、ヒスタミンと他の酸分泌刺激因子との相関関係を個体レベルで解析することが可能となりました。得られた結果から想定されるマウスにおける酸分泌機構を右図に示します。 |
|
| 酸分泌応答に関する新たな視点としては次のものが挙げられます。 (1)HDC 欠損マウスにおけるヒスタミンに対する感受性の増大、最大酸分泌量の増大は、いわゆるリバウンド現象と類似している。リバウンド現象では持続的な酸分泌の抑制により、高ガストリン血症が起こり、ヒスタミンに対する感受性の増大、酸分泌量の増大が認められる。欠損マウスにおける解析からは、ムスカリン神経系の亢進、H2 受容体数の増大、Gs 発現量の増加といった要因がその原因として想定される(さらに詳細なメカニズムの解明のためには壁細胞の単離などの実験が必要とされる)。 (2)マウス個体レベルでは、ヒスタミン刺激による酸分泌は CCK-B 受容体を介する basal レベルの共刺激が必要であると考えられる。これはヒト、イヌでは観察されない現象であるが、マウスにおける解析結果を解釈する上では留意する必要がある。また M3、CCK-B 両受容体は壁細胞においてともに Gq と共役し、細胞内カルシウム濃度の上昇を引き起こすが、カルバコールは単独で酸分泌を引き起こすのに対してガストリンはそうではない。両者の壁細胞におけるシグナル伝達に関しても新たな問題が提起される。 また、H2 受容体欠損マウスとの比較により興味深い新たな問題点も浮き彫りになりました。 (1)H2 受容体欠損マウスでは顕著な胃粘膜の肥厚が観察されるが、HDC 欠損マウスでは8週齢の時点ではそれは観察されず、以後の高い週齢のマウスを用いた検討から、肥厚はあるものの低い程度であることが明らかとなっている。両欠損マウスはともに高ガストリン血症で、胃酸分泌刺激因子に対する応答もヒスタミンを除けば(H2 受容体欠損マウスではヒスタミンに対する応答性はみられない)同じ傾向を示す。以上の結果は、ガストリンの胃粘膜形成作用においてヒスタミンが何らかの作用を有していることを示唆するものである。H2 受容体欠損マウスでは高ガストリン血症に伴い胃粘膜におけるヒスタミン合成が誘導されており(ガストリンは ECL 細胞において HDC を転写レベルで誘導することが報告されている)、高いレベルのヒスタミン代謝回転が観察されていることから、このヒスタミンが細胞増殖に何らかの役割を有している可能性が考えられる。 今後、内在性ヒスタミンを欠くモデル動物として、HDC 欠損マウスは胃酸分泌、胃粘膜形成の解析において重要な新たなツールとなると考えられます。 |
|
| 文献 |
| 1.
Tanaka, S. et al. (2002) Gastroenterology 122, 145-155. 2. Ohtsu, H. et al. (2001) FEBS Lett. 502, 53-56. |