| 1)ヒスチジン脱炭酸酵素 (HDC) の前駆体分子種の解析 |
|
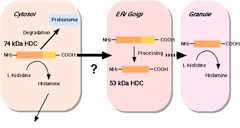
マウス癌化マスト細胞株、P-815
を用いて精製、cDNA クローニングが行われた結果、ヒスチジン脱炭酸酵素 (HDC) は 74-kDa の分子量を有する前駆体として翻訳された後、53-kDa
の成熟体へと変換されることが予想されました(精製、cDNA クローニングの項を参照)。しかしながら、前駆体分子種に相当するタンパク質はその時点では報告されておらず、まず発現系を用いて前駆体分子種を調製し、その性状を検討しました。 |
HDC分子種
|
|||||||||||||||||||||||
|
HDC分子種の性質
|
| 2)抗 HDC 抗血清の調製 |
| マウスにおいて、HDC は翻訳後プロセシングを介してその細胞内局在性を調節している可能性が考えられたので、この点をさらに詳しく解析するために HDC の抗血清を調製しました。 前駆体、成熟体両方を認識する抗体を作成することを目的として、マウス HDC の N-末端 210 アミノ酸残基を glutathione-S-transferase (GST) 融合タンパクとして大腸菌で調製し抗原としました。ウサギを用いて免疫を行い、最も抗体価の高いものを用いました。この抗血清はラットあるいはマウスの胃において HDC を発現する細胞である enterochromaffin-like (ECL) 細胞を特異的に染色することが確認されました(文献3)。 |
Trypsin消化実験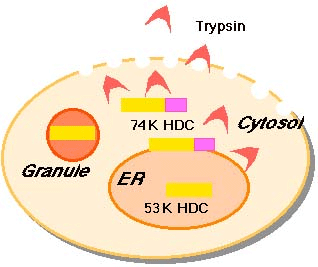 digitonin処理により形質膜を選択的に透過処理した細胞にtrypsinを加え消化を行った。74-kDa分子種は完全に消化され、53-kDa分子種は消化されなかったことから、サイトゾル側には74-kDa分子種が、内腔側には53-kDa分子種が存在していたことが予想される。 digitonin処理により形質膜を選択的に透過処理した細胞にtrypsinを加え消化を行った。74-kDa分子種は完全に消化され、53-kDa分子種は消化されなかったことから、サイトゾル側には74-kDa分子種が、内腔側には53-kDa分子種が存在していたことが予想される。 |
| 3)ラットマスト細胞株における局在性の解析 |
| HDC 活性の高いマスト細胞株として知られる
RBL (rat basophilic leukemia)-2H3 細胞株を用いて、HDC の翻訳後プロセシングおよび細胞内局在性を検討しました。抗
HDC 抗体を用いた免疫沈降法により新生 HDC 分子種の代謝回転を検討したところ、約2分〜30分という非常に速やかな翻訳後プロセシングが起こることが見出されました。また、Percoll
密度勾配遠心法を用いて細胞内オルガネラへの分布を検討したところ、前駆体 74-kDa 分子種はサイトゾル、小胞体画分に、成熟体 53-kDa
分子種は小胞体、ゴルジ、顆粒画分にそれぞれ分布することが明らかとなりました。また、HDC 活性はサイトゾル、顆粒画分にそれぞれ検出されました。 |
HDCの細胞内局在性 |
SRPを介した小胞体への輸送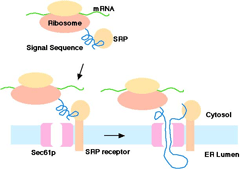 N-末端にシグナル配列を持つタンパク質に見られる小胞体への移行。内腔への移行と翻訳は並行したプロセスである。 |
| 4)前駆体分子種のプロテアソームによる分解 |
| 3)の検討の際に、サイトゾルに存在する前駆体分子種はプロセシングを受けるだけではなく、非常に速やかに、また ATP 依存的に分解されていることが明らかとなりました。サイトゾルにおけるヒスタミン合成の調節機構を考える上で、この分解は重要な仕組みであることが考えられます。そこで様々なプロテアーゼ阻害剤を用いて検討を行いました。その結果、プロテアソームに特異的な阻害剤の一群が前駆体分子種の分解を顕著に抑制することが判りました。またプロテアソーム阻害剤処理後、抗 HDC 抗体で免疫沈降して得られるサイトゾル HDC にはユビキチン抗体に反応性を示す高分子 HDC が検出されました。以上の結果から、前駆体 74-kDa 分子種はサイトゾルでユビキチンによる修飾を受け、プロテアソームにより分解されると考えられます(文献5)。 |
| 5)HDC の小胞体へのターゲッティング機構 |
| 一般的に、分泌タンパクや顆粒成分、膜タンパク質などのほとんどが小胞体に結合したリボソームによって翻訳されることが知られています。これは、それらのタンパク質の
N-末端にシグナル配列と呼ばれる特徴的な疎水性配列があることによって特徴づけることができます。最初に翻訳されるシグナル配列はサイトゾルに存在するシグナル認識粒子
(SRP) と結合することにより、小胞体の SRP 受容体を介してリボソームごと小胞体へと移行します(粗面小胞体)。そこで翻訳と小胞体へのポリペプチドの挿入が同時に起こります。 |
小胞体へ輸送されるタンパク質
|
| 考察 |
| HDC の細胞内局在性に関しては従来はサイトゾル酵素であるという考え方がされていました。それは酵素が可溶性画分に得られること、また近縁酵素であるドーパ脱炭酸酵素
(DDC) がやはり可溶性画分に検出されることなどが根拠となっています。本研究により HDC はマスト細胞においては、サイトゾルで翻訳された後、小胞体でプロセシングを受け顆粒へと輸送されるという新たな知見が得られました。 DDC との相違をもとに考察すると、HDC は DDC と相同性がありますが小胞体移行に関与する C-末端配列は DDC には該当する領域がありません。また、DDC により合成される dopamine は特異的なトランスポーター (vesicular monoamine transporter-2:VMAT-2) を介して顆粒内へと蓄積されると考えられていますが、VMAT-2 のヒスタミンに対する親和性は非常に低くヒスタミンを顆粒へと輸送するトランスポーターに関しては現在特定されているとは言えない状況です。また、HDC はヒスチジンを基質として一段階でヒスタミンを生合成するという特徴も他のアミンとは異なるものです。このような知見を元に考察すると、今回明らかとなった成熟体 HDC の顆粒への局在は顆粒内でヒスタミンが合成されるという新たな視点を提供するものと言えます。 それでは、HDC において何故このような複雑な制御を行いサイトゾル、顆粒という二つのヒスタミンプールを形成する必要があるのでしょうか。一般的にマスト細胞の産生するヒスタミンは顆粒に蓄積され、抗原抗体反応のような刺激を受けて脱顆粒により放出されると考えられています。しかしながら、培養系では無刺激の条件下でも持続的なヒスタミン放出が認められます。ほぼ 100% が生存する条件において今回用いたマスト細胞株は 30 分間で約 5 〜10 % のヒスタミンを細胞外へと放出します。こうした持続的な放出がどんな機能を有するのかは未だ不明ですが、サイトゾルでのヒスタミン合成はこうした持続的な放出に関与するのではないかと考えています。実際に転写レベルで HDC が誘導される際には、この持続的なヒスタミン放出が増加するという結果も知られています。 花粉症に代表されるアレルギー症状は H1 拮抗薬によって緩和されますが、そこで産生されるヒスタミンはどこから供給されるのでしょうか?現在の考え方ではマスト細胞が供給源ですが、脱顆粒によるヒスタミン放出は基本的には一回きりの反応で、顆粒内容物が復元されるのには数日を要すると考えられています。もちろん顆粒に富むマスト細胞が疾患部位に次々とやってくるという考え方もありますが、私たちはマスト細胞による持続的なヒスタミン産生が鍵を握っているのでは、と考えています。今後、in vitro の検討に加えてin vivo の実験も行うことによりヒスタミン産生の調節機構の研究を進めていく予定です。 |
| 文献 |