核酸医薬品による免疫活性化機構の解明と疾患治療への応用
【研究の背景】
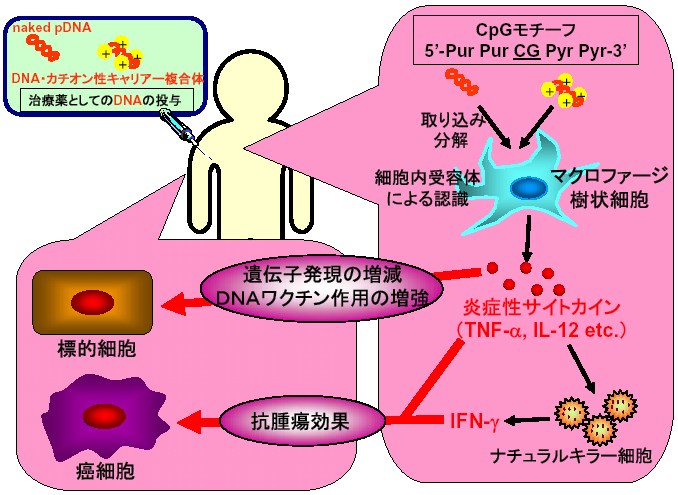
プラスミドDNA(pDNA)は、安全で生産性の高いベクターとして遺伝子治療やDNAワクチン療法への利用が期待されています。pDNAを投与することで優れた治療効果を得るためには、pDNA投与により得られる遺伝子発現プロファイルを対象疾患毎に最適化することが重要です。これまでの検討から、異物に対する免疫応答や生体防御に重要な役割を果たすマクロファージや樹状細胞などの抗原提示細胞が、生体に投与されたpDNAを「異物」として認識し、その体内動態や遺伝子発現に多大な影響を及ぼすことが明らかになってきました。
pDNAを含めた細菌由来のDNAには非メチル化CpG配列、いわゆるCpG motif、が高頻度に存在し、ほ乳類のマクロファージや樹状細胞がこれを取り込むと、細胞内に存在するToll様受容体9(Toll-like
receptor 9; TLR9)を介して危険信号として認識し、種々の炎症性サイトカイン産生などの免疫活性化反応が誘導されます。炎症性サイトカインは、その細胞毒性作用のため標的細胞における遺伝子発現を低下させる原因と考えられます。一方、癌治療を目的とする場合には、導入遺伝子による効果に加えて炎症性サイトカイン産生による免疫活性化も期待できることから、pDNAに対する免疫応答は治療効果に対して複雑な影響を及ぼすと考えられます。しかしながら、マクロファージおよび樹状細胞におけるpDNAの細胞内取り込み・細胞活性化機構については十分に解明されていないのが現状です。 特に、遺伝子発現の増大を目的に汎用されるカチオン性キャリアとの複合体の場合には、CpG motifによる細胞活性化とは異なる機構による免疫活性化が示唆されていますが、その詳細は不明です。
【これまでの研究成果、および今後の検討課題】
私たちの研究室ではこれまでに、マウスおよびラットを用いた検討からpDNAの体内動態には肝臓の非実質細胞が大きく関与することを見出しましています。さらに、この細胞取り込みには、ポリアニオンの立体構造を特異的に認識するスカベンジャーレセプターと類似した機構の関与を明らかにしました。また樹状細胞においても類似の取り込み機構が存在することを明らかにしています(Ref. 2)。一方、細胞の活性化に関する検討から、DNAをカチオン性リポソームとの複合体とすることでCpG motifの有無によらずマクロファージからサイトカインが産生されることを世界に先駆けて見出しました(Ref.1)。TLR9ノックアウトマウス由来マクロファージを用いることで、TLR9がこのCpG motif非依存的な現象に関与しないことも明らかにしています(Ref. 4)。同様のCpG motif非依存的な活性化現象は、マウス樹状細胞、さらにはヒト由来細胞でも起こることを報告しています(Ref. 6-8)。さらにこの細胞活性化が、複合体形成に用いるリポソームの種類には大きく依存することも見出しており、現在細胞内局在との関連について詳細な検討を進めています。
一方、マウス腹腔マクロファージとマクロファージ培養細胞株であるRAW264.7細胞とを比較した検討において、DNA取り込みおよびサイトカイン産生が両細胞群間で大きく異なることを明らかにしました(Ref. 3)。腹腔マクロファージはnaked pDNAを効率よく取り込むものの、ほとんどサイトカインを産生しないことから、DNA結合因子によるTLR9認識阻害を想定し、細胞依存的なnaked CpG DNAによるサイトカイン産生現象の解明に取り組んでいます。
CpG DNAの投与により産生誘導されるTh1型サイトカインは、癌あるいはアレルギー疾患に対して有効な治療効果を示すと考えられます。私たちは、CpG DNAを利用したサイトカイン誘導による疾患治療を実現するために、CpG DNAによる免疫活性化の増強にも取り組んでいます。ここでは、部分的に相補的な配列を持つ3本の短いDNAを組み合わせることでY型DNAを構築し、このユニークな構造体が同一配列の二本鎖DNAよりもサイトカイン産生を効率よく誘導することを見いだしています。現在、Y型DNAを基本骨格としたDNA構造体を開発することで、免疫活性化能のさらなる増強、免疫担当細胞へのデリバリー効率の改善に取り組んでいます。さらに、インターカレーションによりDNAと結合する抗癌剤を組み合わせた薬物・免疫治療システムの開発を試みています。

【発表論文】
1.
Plasmid DNA Activates Murine Macrophages to
Induce Inflammatory Cytokines in a CpG Motif-Independent Manner by Complex
Formation with Cationic Liposomes
Kei
Yasuda, Yoshiyuki Ogawa, Michiyuki Kishimoto, Toshihide Takagi, Mitsuru Hashida
and Yoshinobu Takakura
Biochem. Biophys. Res. Commun., 293(1):344-8 (2002) Abstract
(PubMed)
2.
Efficient uptake and rapid degradation of
plasmid DNA by murine dendritic cells via a specific mechanism
Takaharu
Yoshinaga, Kei Yasuda, Yoshiyuki Ogawa and Yoshinobu Takakura
Biochem. Biophys. Res. Commun., 299(3):389-94 (2002) Abstract (PubMed)
3.
Efficient uptake and rapid degradation of
plasmid DNA by murine dendritic cells via a specific mechanism
Takaharu
Yoshinaga, Kei Yasuda, Yoshiyuki Ogawa and Yoshinobu Takakura
Biochem. Biophys. Res. Commun., 299(3):389-94 (2002) Abstract (PubMed)
4.
Macrophage activation by a DNA/cationic liposome
complex requires endosomal acidification and TLR9-dependent and -independent
pathways
Kei Yasuda, Yoshiyuki Ogawa, Ikuko Yamane, Makiya Nishikawa and Yoshinobu
Takakura
J Leukoc Biol. 2005 Jan;77 (1):71. Abstract (PubMed)
5.
The uptake and degradation of DNA is impaired in
macrophages and dendritic cells from NZB/W F(1) mice
Yoshiyuki Ogawa, Takaharu Yoshinaga, Kei Yasuda, Makiya Nishikawa and Yoshinobu
Takakura
Immunol Lett. 2005 Oct 15;101 (1):32-40. Abstract (PubMed)
6.
Cellular uptake and activation characteristics
of naked plasmid DNA and its cationic liposome complex in human
macrophages
Ikuko Yamane, Makiya Nishikawa and Yoshinobu Takakura
Int J Pharm. 2005 Nov 23;305 (1-2):145-53. Abstract (PubMed)
7.
DNA and its cationic lipid complexes induce CpG
motif-dependent activation of murine dendritic cells
Takaharu Yoshinaga, Kei Yasuda, Yoshiyuki Ogawa, Makiya
Nishikawa and Yoshinobu Takakura
Immunology. 2007 Mar;120 (3):295-302. Abstract (PubMed)
8.
Plasmid DNA uptake and subsequent cellular
activation characteristics in human monocyte-derived cells in primary culture
Yuga Fukuhara, Tomoyuki Naoi, Yoshiyuki Ogawa, Makiya
Nishikawa and Yoshinobu Takakura
Journal of Pharmaceutical Sciences. 2007 Jun;96 (6):1576-84. Abstract (PubMed)
|
|