免疫応答制御を目指したタンパク質・DNAワクチンの開発
【研究の背景】
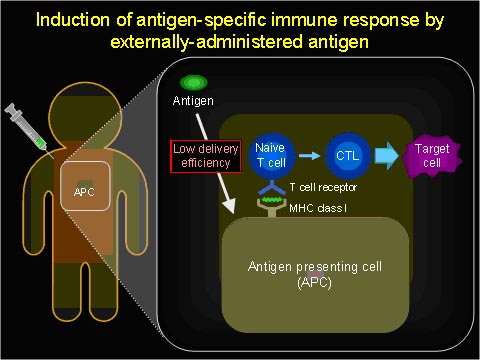
癌や感染症の治療には細胞傷害性 T リンパ球 (CTL) を誘導することが有効であり、抗原特異的な免疫を誘導可能な免疫療法が有望視されています。
一般に CTL の誘導には、マクロファージや樹状細胞などの抗原提示細胞 (APC) が抗原タンパク質・抗原ペプチドを取り込むこと、細胞内で生成された抗原由来のペプチド断片が
MHC class I 分子上に提示されることが必要です。私たちはこれまでに、抗原タンパク質に対して化学修飾を施し、APCへのデリバリーを増大することで、CTL誘導が増強可能であること、これにより抗腫瘍効果が増大することを、モデル抗原卵白アルブミン(OVA)を用いた検討から明らかにしてきました1-6)。
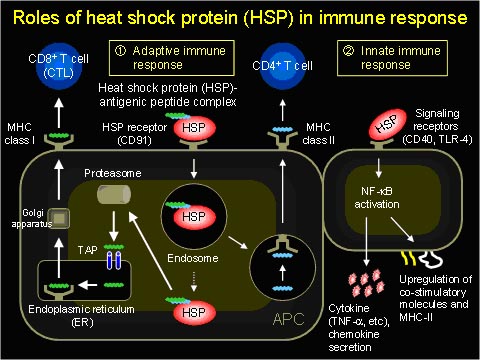
近年、分子シャペロンとして知られるheat shock protein 70(Hsp70)が腫瘍免疫分野において強力な免疫賦活化物質として注目されています。Hsp70は、C末側に抗原ペプチドと結合可能なドメインを有することから、抗原ペプチドと混合することで複合体が形成されます。Hsp70−抗原結合体は、APCに発現するHspレセプターを介して細胞内に取り込まれます。通常、レセプターを介して取り込まれたリガンドはリソソームで分解され、MHCクラスII分子に提示されますが、Hsp70の場合には「クロスプレゼンテーション」と呼ばれる機構により、クラスI分子上にも抗原が提示されます。また、別のレセプターへの結合により、APCを活性化するアジュバント活性をも有しています。以上のことから、Hsp70は理想的な抗原キャリアと考えられ、これまでにもHsp70を利用した抗原デリバリーが試みられてきましたが、未だ十分な治療効果が得られていないのが現状です。私たちは、Hsp70の体内および細胞内動態を厳密に制御することで、抗原特異的な免疫応答誘導を増強できると考えました。そこで、体内動態制御に必要な基本情報としてHsp70の体内動態特性を明らかにするとともに、Hsp70に種々の機能性分子を搭載した新規誘導体の開発を行い、Hep70を基盤とする新規抗腫瘍免疫治療システムの開発を目指しています。
【これまでの研究成果】
Hsp70を基盤とする抗原デリバリーシステムの開発を目的としたHsp70の体内動態解析7)
Hspに対するレセプターの存在は報告されていましたが、細胞外のHsp70が生体内でどのように挙動するかについては全く情報がありませんでした。そこで私たちは、111Inで放射標識したマウスHsp70を用い、マウスに投与後の体内動態特性の解明を試みました。その結果、静脈内投与されたHsp70は血中より速やかに消失し、主に肝臓の実質細胞に集積することが明らかとなりました。レセプターに対するリガンドを用いた検討から、その取り込みにはCD91が関与することも示されています。一方、皮下に投与すると、所属リンパ節に高濃度に集積しました。
抗原ペプチド結合型Hsp70の開発8)
Hsp70にOVAのMHC class Iエピトープ(pepI; OVA257-264, SIINFEKL)を結合した融合タンパク質を用いることで、抗原特異的なCTL誘導が可能であることが報告されています。しかしながら、APCへのデリバリー効率が低いことなどのために、十分な免疫応答が得られていません。私たちは、CTL誘導の増強を目的に、APC内で抗原を積極的にMHC class I分子上にデリバリー可能な新規ワクチンの開発を試みました。エンドサイトーシスされた融合タンパク質を細胞質へ送り込むための機能分子としてpolyhistidine(His)を選択し、Hsp70融合タンパク質に組み込むことで抗原デリバリーにおける有用性について検討しました。その結果、polyhistidineを融合させたHSP70-抗原結合体(His-HSP70-pepI)は、Hsp70-pepIと比較してAPCに取り込まれた後、細胞質への移行が亢進し、抗原をMHC class I 上に効率よく提示しました。また、この融合タンパク質を投与することで、マウスにおいて抗原特異的なCTL誘導の増強に成功しています。
さらに高いCTL活性の誘導には MHC class Iエピトープのみならず、MHC class IIエピトープ(pepII)も同時にAPCにデリバリーすることが重要となります。そこで、私たちはHsp70にOVAの代表的MHC class IエピトープpepI(OVA257-264)とclass IIエピトープpepII(OVA323-339)を同時に搭載したHsp70誘導体を開発しました。マウスに対して免疫実験を行なった結果、pepII-Hsp70-pepI投与群はHsp70-pepIとpepII-Hsp70の混合物投与群やHsp70-pepI単独投与群に比較して、非常に高いCTL活性を示すとともにOVA発現マウス胸腺腫細胞株EG7が形成する腫瘍増殖の有意な抑制する結果を得ています。これにより同一APC上にMHC class I、class IIの両エピトープを提示させることの有用性を実証することができました。
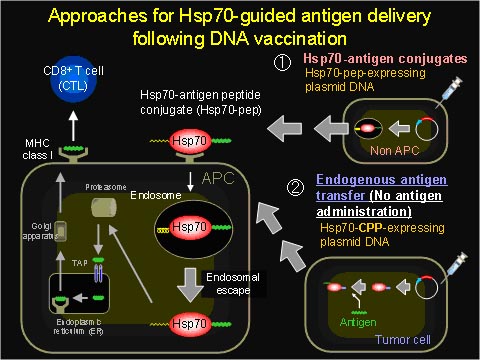
癌細胞内にはさまざまな癌抗原が存在することから、これをうまく利用することができれば抗腫瘍免疫が誘導可能と考えられます。しかしながら、その実現には癌細胞内の抗原を癌細胞外へ運び出し、APCにデリバリーすることが必要となります。私たちは、この2段階のデリバリーを実現することを目的に、癌抗原ペプチドを結合し、APCにデリバリーする分子としてHsp70を、癌細胞内で形成されるHsp70−癌抗原ペプチド複合体を細胞外へ輸送する分子として細胞膜透過ペプチドである単純ヘルペスウイルス由来VP22タンパク質を選択し、融合タンパク質を発現するプラスミドベクターを構築しました。Hsp70とVP22タンパク質の細胞透過ペプチド部分(△VP22)の融合タンパク質を発現するpHsp70-△VP22)を癌細胞へ遺伝子導入し、これによる抗腫瘍免疫の誘導について検討しました。その結果、pHsp70投与群と比較してpHsp70-△VP22投与群ではCTL の誘導ならびに抗体産生が有意に高いことが示され、腫瘍増殖の抑制ならびに生存日数の延長も認められました。
以上の結果から、膜透過ペプチド融合Hsp70を発現するプラスミドDNAを癌細胞に遺伝子導入することで、癌細胞内の抗原ペプチドを細胞外に輸送可能であることが示されました。
現在、癌細胞内の抗原ペプチドをより効率的に細胞外にデリバリーするため、癌細胞膜に小孔(ポア)を形成するタンパク質を発現させることでHsp70−抗原ペプチド複合体を含めて癌細胞内容物を細胞外に運び出す新たなワクチン開発に取り組んでいます。
癌抗原を同定せず、患者(担癌動物)に投与しないというこれらの手法により、ワクチン開発が劇的に簡略化できるだけでなく、特定抗原の有無を問うことなく大多数の癌患者への投与が可能になることが期待されます。その実現のためには、癌細胞内の癌抗原を細胞外へ、さらには免疫誘導に重要なAPCへデリバリーすることが必要であり、これまでの薬物動態学、腫瘍免疫学研究から解明してきたAPCでの高分子化合物の細胞内動態および免疫応答に関する情報をもとに、効果的なワクチンシステムの開発を目指しています。
【参考文献】
-
Efficient scavenger receptor-mediated hepatic targeting of proteins by
introduction of negative charges on the proteins by aconitylation: the
influence of charge density and size of the proteins molecules
Yamasaki Y, Hisazumi J, Yamaoka K and Takakura Y.
Eur J Pharm Sci. 2003 Apr;18(5):305-12. Abstract (PubMed) - Efficient scavenger receptor-mediated uptake and cross-presentation of negatively charged soluble antigens by dendritic cells
Shakushiro K, Yamasaki Y, Nishikawa M and Takakura Y.
Immunology. 2004 Jun;112(2):211-8. Abstract (PubMed) - Induction of cytotoxic T lymphocytes following immunization with cationized
soluble antigen
Ikenaga T, Yamasaki Y, Shakushiro K, Nishikawa M and Takakura Y.
Vaccine. 2004 Jun 30;22(20):2609-16. Abstract (PubMed) - Manipulation of local disposition and gene expression characteristics of
plasmid DNA following intramuscular administration by complexation with
cationic macromolecule
Kawase A, Kobayashi N, Isaji K, Nishikawa M and Takakura Y.
Int J Pharm. 2005 Apr 11;293(1-2):291-301. Abstract (PubMed) - Enhanced antigen-specific antibody production following polyplex-based
DNA vaccination via the intradermal route in mice
Kawase A, Isaji K, Yamaoka A, Kobayashi N, Nishikawa M and Takakura Y.
Vaccine. 2006 Jul 7;24(27-28):5535-45. Abstract (PubMed) - Induction of antigen-specific cytotoxic T lymphocytes by immunization with negatively charged soluble antigen through scavenger receptor-mediated delivery
Yamasaki Y, Ikenaga T, Otsuki T, Nishikawa M and Takakura Y.
Vaccine. 2007 Jan 2;25(1):85-91. Abstract (PubMed) - Pharmacokinetic and tissue distribution mechanism of mouse recombinant heat shock protein 70 in mice.
Takemoto S, Nishikawa M, Takakura Y.
Pharm Res. 2005 Mar;22(3):419-26.Abstract (PubMed) - Hsp-based tumor vaccines: state-of-the-art and future directions.
Takakura Y, Takemoto S, Nishikawa M.
Curr Opin Mol Ther. 2007 Aug;9(4):385-91. Abstract (PubMed)