��`�q���ÁEDNA���N�`���Ö@�̍œK����ڎw����
�j�_���i�J��
�y�����w�i�z
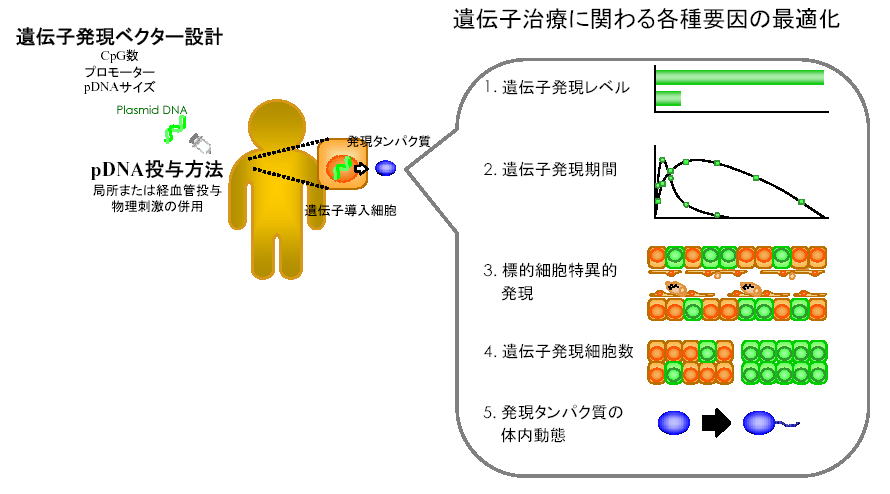
���������^���p�N������`�q�̌`�œ��^�����`�q���ẤA��������ɑ��鍪���Ö@�Ƃ��Ċ��҂���Ă��܂��B���l�ɁA����E�C���X�����A�A�����M�[�����Ȃǂɑ��ẮA�R���^���p�N�����R�[�h�����`�q�𓊗^����DNA���N�`���Ö@�̊J�������҂���Ă��܂��B�����������݂ɂ����ẮA��`�q��W�I�זE���Ɍ����悭�������邱�Ƃ��K�{�ł���A������������邽�߂ɃE�C���X�E��E�C���X�x�N�^�[�̊J�������E���Ői�߂��Ă��܂����B��`�q���������ɗD���E�C���X�x�N�^�[��p�����������L���s���Ă��܂����A���S���̂┒���a���ǂȂǁA�d��ȗL�Q���ۂ����Ƃ���Ă��܂��B����ɑ��A�v���X�~�h DNA(pDNA) ����{�Ƃ����E�C���X�x�N�^�[�́A���S���E�ėp���̊ϓ_����L�]������Ă��܂������A���×p��`�q�����x�N�^�[�Ƃ��Ă̊J���ɂ͒Ⴂ��`�q���������̑啝�ȉ��P���K�v�Ƃ���Ă��܂����B�ߔN�A��e�ʂ�pDNA���n�t���}���ɐÖ������^����u�n�C�h���_�C�i�~�N�X�@�v��d�C�p���X�Ȃǂ̕����h���𗘗p������@�Ȃǂ��J������A��E�C���X�x�N�^�[�̈�`�q�������������P����A���ÂɕK�v�ȃ��x���̈�`�q������������悤�ɂȂ��Ă��܂����B��E�C���X�x�N�^�[�ɂ���`�q������L���Ȏ������Ö@�Ƃ��邽�߂ɂ́A�x�N�^�[�E��`�q�̑̓����Ԃ̍œK����Y���^���p�N���̓��Ԑ���ȂǁA����ɂ킽��ߒ��ł̉��P���\�ƍl�����܂��B
�y�������ʁz
�������͂���܂ł�pDNA�𗘗p������`�q�����Ɋւ��āA�����Ƀ}�E�X��p����in vivo�ł̌�����i�߂Ă��܂����B��e�ʂ�naked pDNA���n�t���}���ɐÖ������^���邱�ƂŊ̑��ɂ����č�����`�q������������n�C�h���_�C�i�~�N�X�@�ɒ��ڂ��A����܂łɂ��̓����I�ȑ̓����ԂȂ�тɍזE���ڍs���J�j�Y���𐢊E�ɐ�삯�Ė��炩�ɂ��܂����B���̓����@�̏ꍇ�A�ꎞ�I�ɍזE�����ߐ������i���ApDNA�Ɍ��炸�^���p�N��������q�����ڍזE�����Ɉڍs���邱�Ƃ��A�}�E�X��p�����������玦���Ă��܂�1, 2)�B���̕��@��p�����C���^�[�t�F������`�q�����ɂ�荂���R��ᇌ��ʂ邱�Ƃɐ������Ă��܂�3)�B����ɂ́ApDNA����CpG���`�[�t���팸�����v���X�~�h���J�����A��`�q���������������邱�ƂŌ��ʂ����܂���4)�B�܂��A�n�C�h���_�C�i�~�N�X�@�̌��������p���邱�ƂŁA�ؓ��זE�ɑ��Ă��������Ɉ�`�q���f���o���[�\�ȕ��@�̊J���ɂ��������A�W�X�g���t�B����`�q�����ɂ��W�X�g���t�B�[���Âɂ��Ă��������Ă��܂�5)�B
�@����ADNA���N�`���ɂ��R��ᇖƉu�̗U����ړI�Ƃ��čזE���ٓI�ȃf���o���[���\�ɂ����E�C���X�x�N�^�[�̊J���ɐ������A�R���זE��W�I�Ƃ����R��ᇖƉu�̗U�����\�ł��邱�Ƃ������Ă��܂�6, 7)�B�������Ȃ���A���̂悤�Ȉ�`�q�f���o���[�V�X�e���͈�`�q�����E�������������ɒႭ�A���̂��Ƃ����L���ȃV�X�e���J����j�ޗv���ł��邱�Ƃ����炩�ƂȂ�܂����B�����ŁA�R��������pDNA���^�ɂ��R��ᇖƉu�̗U���Ɋւ��ẮA�����������\���łȂ����Ƃ𖾂炩�ɂ����R���זE�ւ̈�`�q�����̃A�v���[�`�ł͂Ȃ��A����ȊO�̍זE�Ŕ����������R�����R���זE�Ƀf���o���[���邱�ƂɎ��g��ł��܂��B�R���זE�ւ́u�L�����A�v�ɂ͔M�V���b�N�^���p�N����I�����A����ɍR�����q�Ɠ��Ԑ���@�\�^�����Z���^���p�N��������pDNA�������^���邱�ƂŁA���͂ȍזE���Q��T�����p���̗U�����\�ł��邱�Ƃ������܂����B
�ȏ�̂悤�ɁA�������͒P�Ɉ�`�q�������������P���邾���łȂ��A��`�q�Y���̕��q�v���瓱����`�q�̍Ċ������܂ł��I�ɓ��䂷�邱�Ƃɂ���`�q���ÁEDNA���N�`���Ö@�̍œK���Ɏ��g��ł��܂����B����A�@��`�q�Y���i�^���p�N���j�̕��q�v�i�T�C�Y��d�ׁA���ٓI�@�\���q�̗L���j�A�A�v���X�~�h�x�N�^�[�v�E�J���i�v�����[�^�̑I���A�T�C�Y�ECpG���`�[�t���̐���j�A�B�x�N�^�[���^���@�̑I���E�œK���A�C��`�q�����Ċ������@�\�̗��p�A�Ɋւ��đΏێ����E���Ã^���p�N�����ɃV�X�e���̍œK����}��A�L���Ȉ�`�q���ÁEDNA���N�`���Ö@�������������ƍl���Ă��܂��B�@

�y�Q�l�����z
1.
Hydrodynamic-based Procedure Invovlves
Transient Hyperpermeability in the Hepatic Cellular Membrane: Implication of a
Nonspecific Process in Efficient Intracellular Gene Delivery
Naoki Kobayashi, Makiya Nishikawa, Kazauhiro Hirata and Yoshinobu Takakura
J Gene Med. 2004 May;6 (5):584-92. Abstract (PubMed)
2.
Hepatic Delivery of Particulates in the
Submicron Range by a Hydrodynamic-based Procedure: Implications for Particulate
Gene Delivery Systems
Naoki Kobayashi, Kazuhiro Hirata, Shi Chen, Atsushi Kawase, Makiya Nishikawa
and Yoshinobu Takakura
J Gene Med. 2004 Apr;6 (4):455-63. Abstract (PubMed)
3.
Therapeutic Effect of intravenous interferon
gene delivery with naked plasmid DNA in murine metastasis models
Naoki Kobayashi, Takeshi Kuramoto, Shi Chen, Yoshihiko Watanabe and Yoshinobu
Takakura
Mol Ther. 2002 Dec;6 (6):737-44. Abstract (PubMed)
4.
Improved anti-cancer effect of interferon gene
transfer by sustained expression using CpG-reduced plasmid DNA
Hiroki Kawano, Makiya Nishikawa, Masaru Mitsui, Yuki Takahashi, Keiko Kako,
Kiyoshi Yamaoka, Yoshihiko Watanabe and Yoshinobu
Takakura
International journal of Cancer. 2007 Jul 15;121 (2):401-6. Abstract (PubMed)
5.
Restoration of dystrophin expression in mdx
mice by intravascular injection of naked DNA containing full-length dystrophin
cDNA.
Liang KW, Nishikawa M, Liu F, Sun B, Ye Q, Huang L
Gene Therapy. 2004 Jun;11 (11):901-8. Abstract (PubMed)
6.
Manipulation of local disposition and gene
expression characteristics of plasmid DNA following intramuscular
administration by complexation with cationic macromolecule
Atsushi Kawase, Naoki Kobayashi, Keiko Isaji, Makiya Nishikawa and Yoshinobu
Takakura
Int J Pharm. 2005 Apr 11;293 (1-2):291-301. Abstract (PubMed)
7.
Enhanced antigen-specific antibody production
following polyplex-based DNA vaccination via the intradermal route in mice
Atsushi Kawase, Keiko Isaji, Ayumi Yamaoka, Naoki Kobayashi, Makiya Nishikawa
and Yoshinobu Takakura
Vaccine. 2006 Jul 7;24 (27-28):5535-45. Abstract (PubMed)