研究テーマ
高度化する医療の中で医薬品の果たすべき役割が大きくなる中で、その有効性と安全性の質保証が求められています。薬物動態は生体に投与された医薬品の吸収、分布、代謝、排泄という4つの主なプロセスによって構成され、各プロセスのトータルバランスが標的および標的以外の組織・細胞での薬物濃度推移を決定し、薬効や副作用の発現に密接に影響します。したがって、創薬では動態特性の優れた候補物質の探索および動態の制御が、臨床では薬物動態の個体間変動に基づく投与計画の最適化が求められます。数理治療薬学分野では、薬物動態・薬効・毒性/副作用に関するメカニズムを定量的に解析し、医薬品の設計や適正使用に資する研究を行っています。
以下に、当分野の研究テーマと具体的な研究内容を示します。
- マイクロ流体デバイスを利用した薬物動態・毒性評価システムの開発
- 臨床情報解析による薬効および副作用リスクの予測
- AI/機械学習を駆使した薬物動態の予測法の開発
- オミクス情報に基づく疾患の発症機序解明と診断マーカーおよび予防薬の開発
- 環境因子による上皮性炎症機序解明と治療法の開発
- 副作用発現の分子動態学的・薬理学的解析と予防・治療法への展開
に関する研究を実施しています。
1. マイクロ流体デバイスを利用した薬物動態・毒性評価システムの開発研究
創薬研究における薬効・毒性評価では、ヒト培養細胞を用いたin vitro実験が広く利用されていますが、従来の2D培養系では、in vivo実験との間に乖離が認められることがありました。最近注目されているマイクロ流体デバイス(臓器チップ)は、微小空間で単一の臓器機能や構造を再現したり、複数の臓器モデルを連結して薬物の吸収・代謝などの体内動態を模倣したりするin vitro実験技術です。これまで私たちは、薬物吸着性を軽減したり伸展刺激を印加したりしたマイクロ流体デバイスを開発しました。複数の細胞種を3D環境で灌流培養することによって、ヒト組織での薬物動態や毒性をチップ上で評価しています。
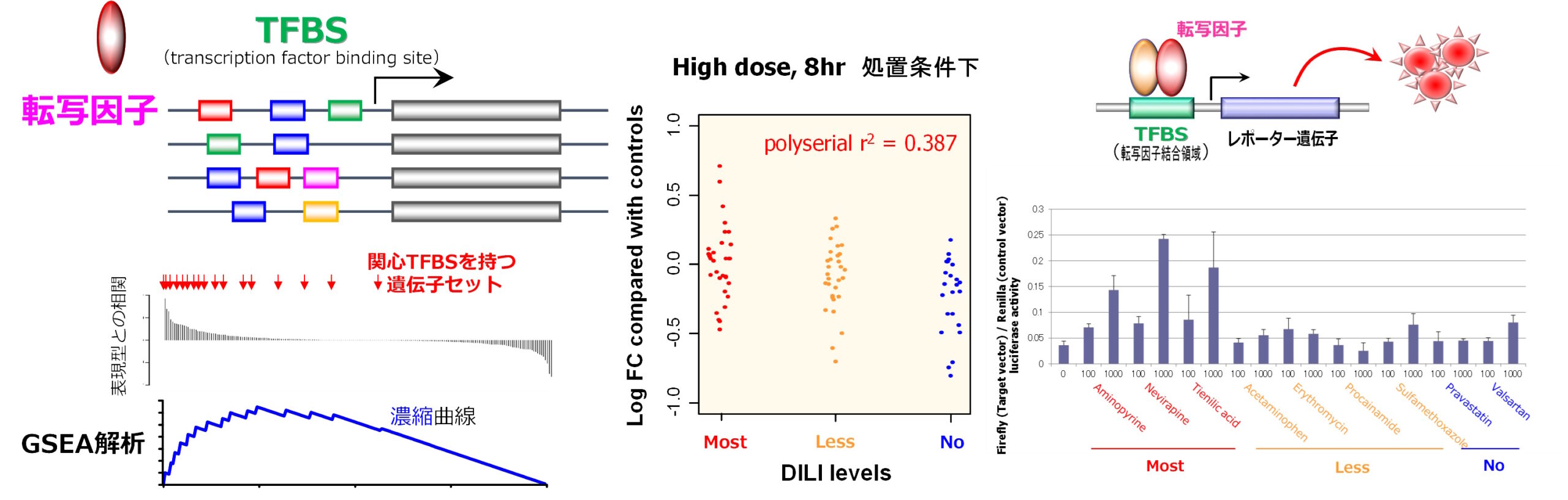
2. 臨床情報解析による薬効および副作用リスクの予測
医薬品の副作用は、それが起きた患者に対して臨床的な負担をもたらす上、医療現場や製薬企業にも社会的、経済的分担を強いることになります。市販後の安全性情報に関する大規模データを疫学的に解析することによって、副作用発現における特徴量を見出し、リスク低減・回避に向けた行動計画を立案できます。現在、肝毒性のある薬物を網羅的に探索してバイオマーカーを見出し、リスク評価に応用しようとする研究を展開しています。
3. AI/機械学習を駆使した薬物動態の予測法の開発
薬物の体内動態は様々な要因によって支配されます。化学構造の違いによって物性が変わったり、薬物代謝酵素やトランスポーターによる分子認識や反応性が変わったりします。また、同じ医薬品を投与しても患者間での体内動態の個体間変動がみられ、これらには患者の体格、肝/腎疾患の有無、遺伝多型の違いなどが影響するとされています。これらの潜在的なパターンをAI/機械学習によってモデル化できれば医薬品開発の効率化や臨床での個別化治療計画の立案が可能になります。そのために、遺伝的アルゴリズムを使ってデータ駆動モデル式を進化的に探索する方法など、さまざまなAI/機械学習ツールを開発しています。
4. オミクス情報に基づく疾患の発症機序解明と診断マーカーおよび予防薬の開発
オミクス解析は、生物学や医学において、大規模なデータセットを用いて生物学的な情報を解析する手法の総称です。バイオインフォマティクスの手法により行われ、生物の機能や疾患のメカニズム、新たな治療法の開発などに関する情報を得ることができます。私たちは、疾患モデル動物のオミクス解析から、疾患の分子基盤や生理学的プロセスを包括的に理解し、予防法・治療法の開発や診断マーカーの探索につながるツールとして利用しています。
5. 副作用発現の分子動態学的・薬理学的解析と予防・治療法への展開
医薬品による副作用は、臨床現場においてしばしば生じる問題であり、患者のQOL の低下を招くほか、治療の妨げとなっています。その発現のメカニズムを薬物動態学的・薬理学的側面から明らかにすることで、副作用への対応が可能となり、その発現の予防や症状の軽減に繋げることができます。私たちは、がん化学療法時に発生する副作用である味覚障害のメカニズム解析や、医薬品や環境因子による上皮性炎症機序の解明を行っています。
主要論文
Ota R, So K, Tsuda M, Higuchi Y, Yamashita F. Prediction of HIV drug resistance based on the 3D protein structure: Proposal of molecular field mapping. PLoS One, 16(8), e0255693 (2021).
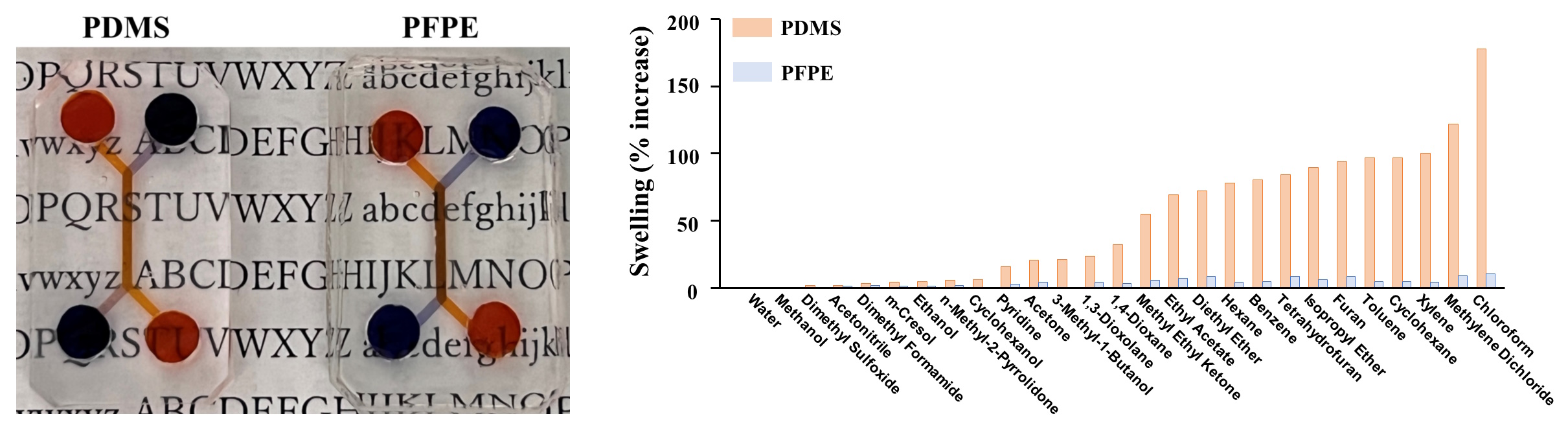
Wang M, Tsuda M, Deguchi S, Higuchi Y, So K, Torisawa YS, Takayama K, Yamashita F: Application of perfluoropolyether elastomers in microfluidic drug metabolism assays. Int J Pharm, 627, 122253 (2022).
Zhang Q, Taniguchi S, So K, Tsuda M, Higuchi Y, Hashida M, Yamashita F. CREB is a potential marker associated with drug-induced liver injury: identification and validation through transcriptome database analysis. J Toxicol Sci, 47(8), 337-348 (2022).
Chantarasrivong C, Okada R, Yamanea Y, Yang X, Higuchi Y, Konishi M, Komura N, Ando H, Yokokawa R, Yamashita F, Disposition of E-selectin-targeting liposomes in tumor spheroids with a perfusable vascular network. Drug Metab Pharmacokinet, 46, 100469 (2022).
Uno M, Nakamaru Y, Yamashita F: Application of machine learning techniques in population pharmacokinetics/pharmacodynamics modeling. Drug Metab Pharmacokinet, in press.