なぜ精神疾患の研究・セロトニン神経の研究を行うのか
うつ病や統合失調症、薬物依存症や強迫性障害(OCD)などの精神疾患は、日本を含む先進各国において大きな社会問題となっている疾患群です。患者数は日本だけでも400万人を超えており、特にうつ病を含む気分障害の患者数は、平成14年から平成29年までの15年で約1.8倍に増加しています。従って、より高い治療効果を迅速にもたらし得る治療法の開発は急務と考えられます。
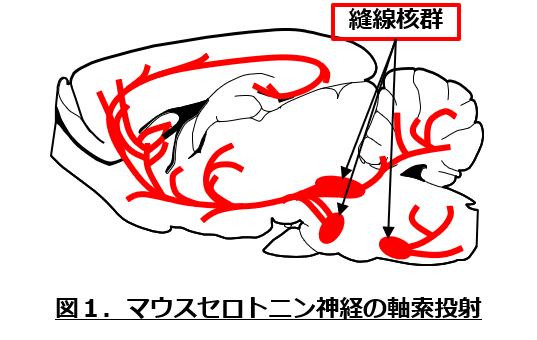
神経伝達物質の一つであるセロトニンは、上記の精神疾患の全てと密接にかかわることがこれまでの研究から示されています。例えば、うつ病の治療に用いられる抗うつ薬のほとんど全てが、セロトニンの再取り込みを司るセロトニントランスポーターを阻害しますし、コカインやMDMAといった麻薬の多くは、ドパミンに加えて(あるいはそれより強く)セロトニンの細胞外濃度を急速に高めます。また近年では、セロトニン神経がこれらの情動制御のみならず、意思決定の脳内プロセスにも関与することが示されつつあります。しかし、セロトニン神経は縫線核という一群の神経核から上行性および下行性に投射する典型的なwidely projecting neuronであり、その投射先が広範に及ぶことから(図1)、ドパミン神経系のように各投射経路がどのような生理機能を果たしているのか、ほとんど分かっていません。
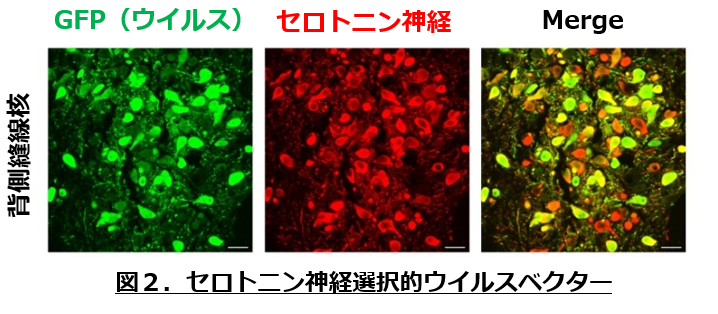
当分野ではこれまでに、最大のセロトニン神経核である背側縫線核を含む中脳切片培養系や、in vivoマイクロダイアリシス法を用いて、依存性薬物、抗うつ薬、抗精神病薬によるセロトニン神経活動の亢進とその分子機構を明らかにしてきました(Higuchi et al., 2008; Nagayasu et al., 2010a, 2010b, 2013; Nishitani et al., 2014; Asaoka et al., 2015; Kinoshita et al., 2018)。さらに最近、セロトニン神経のみに遺伝子を導入できるウイルスベクターを開発し、光依存性のカチオンチャネルであるチャネルロドプシン2(ChR2)など光遺伝学的ツールと組み合わせた検討も行っており、マウスおよびラットの背側縫線核セロトニン神経を選択的に活性化させるだけで、抗うつ効果が引き起こされることを明らかにしてきました(Nishitani et al., 2019; 図2)。このウイルスベクターを用いて、特定の神経核へと投射するセロトニン神経のみを活性化したり、特定の遺伝子の発現を抑制したりすることで、情動制御・意思決定に関与するセロトニン神経を同定し、その動作原理を明らかにすることが可能になったと考えています。
現在とこれからの取り組み


ある神経回路が有する生理的な意義を明らかにするためには、(1)観察(2)介入の2種類の実験が必要です。現在私たちはセロトニン神経選択的に、神経活動レベル・遺伝子発現レベルでこの観察と介入の両者を行っています(表)。この観察と介入を通じて、セロトニン神経活動がコードしているものが何であるのか、解き明かしたいと考えています。
具体的に行っている検討は以下の通りですが、上記の目的に合致したものであれば手段は問いません。
情動制御におけるセロトニン神経の役割
- 報酬/嫌悪刺激に対するセロトニン神経の応答を、in vivoファイバーフォトメトリー法を用いて調べるとともに、その活動変化を光遺伝学的手法で模倣した際の行動学的変容を明らかにします
- 上記のセロトニン神経の応答が、社会的敗北ストレスおよび抗うつ薬の慢性投与でどのように変化するのか調べるとともに、光遺伝学的手法により介入することで抗うつ薬による治療効果を永続させるために必要な条件を明らかにします
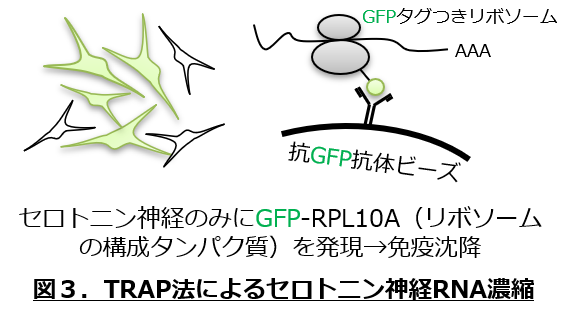
- 上記の活動変化の根底にある分子メカニズムを明らかにするため、Translating Ribosome Affinity Purification法(TRAP法; 図3)を用いてセロトニン神経のみからmRNAを単離し網羅的遺伝子発現解析を行うとともに、神経細胞種特異的に遺伝子発現抑制/過剰発現を行った際の行動への影響を解析します
意思決定におけるセロトニン神経の役割
- 確率的逆転学習課題を用いて、意思決定過程の各段階におけるセロトニン神経活動を測定し、その活動変化を薬理学的/光遺伝学的手法で誘導した際の行動への影響を、数理モデルを用いて詳細に解析します。また、病態モデルマウスにおいて同様の検討を行い、疾患において障害されている神経回路の同定とその治療方策の探索を図ります
幹細胞から誘導したヒトセロトニン神経細胞の解析
- 健常者由来ヒトiPS細胞および変異導入iPS細胞から分化誘導して得たセロトニン神経の活動性/薬物反応性を評価することで、精神疾患症状を含む遺伝性疾患の原因と治療候補化合物の探索を行います。大阪大学との共同研究です。
何が得られるか
セロトニン神経回路が有する病態生理学的意義を解明することで、精神疾患の病態と意思決定プロセス自体の生物学的理解が進展します。またその分子基盤を明らかにすることで、特定のセロトニン神経系の機能を修飾する特異的物質の探索等を通じて、情動制御/意思決定プロセスの障害に対して選択的に作用する薬物の創出、すなわち「神経回路創薬」に資する知見が得られます。これは先天的あるいは後天的な自然発症だけでなく、薬物治療(あるいは薬物乱用)の結果として臨床で問題となる衝動性や攻撃性あるいは強迫性行動など、従来の精神疾患治療薬がカバーできなかった臨床ニーズに応えることのできる重要な創薬ターゲットとなる可能性が高いと考えています。
さらに我々はこれまでマウス、ラットだけでなく、霊長類のプロモータを用いた細胞種特異的かつ強力なウイルスベクターの作製にも成功しており(Nagai et al., 2019; 関西医大、京大霊長研との共同研究)、このウイルス技術は非ヒト霊長類での研究にも応用可能で、齧歯類のみでは評価し得ない「幸福」とは何かという高次脳機能の理解に繋がる将来の研究にも大きな材料とインパクトを与える学術的な波及効果の大きな研究であると期待しています。



























