研究内容
有机合成化学是一门用于创造物质材料、药物以及其它能够为人们带来更好生活的有机化合物的基础科学和技术。该领域研究进展的关键,是开发新的合成方法,利用高活性化学物质合成有用的分子。为了实现这一使命,我们课题组基于新型催化剂设计开发,致力于控制活性物种的反应性,开发建立了开创性的新方法和新体系。
目前的研究
开发有机自由基生成的新方法
区别于传统的离子(阴离子,阳离子),自由基显示出独特的反应性和选择性,为有机化学提供了强大的合成工具。然而,由于缺乏产生自由基的实用方法,自由基化学还没有发展到一个综合有用的水平,尚落后于离子化学。我们课题组基于温和的条件下产生各类自由基,以应用于各种键的构建,开发了以下新颖的自由基生成方法。
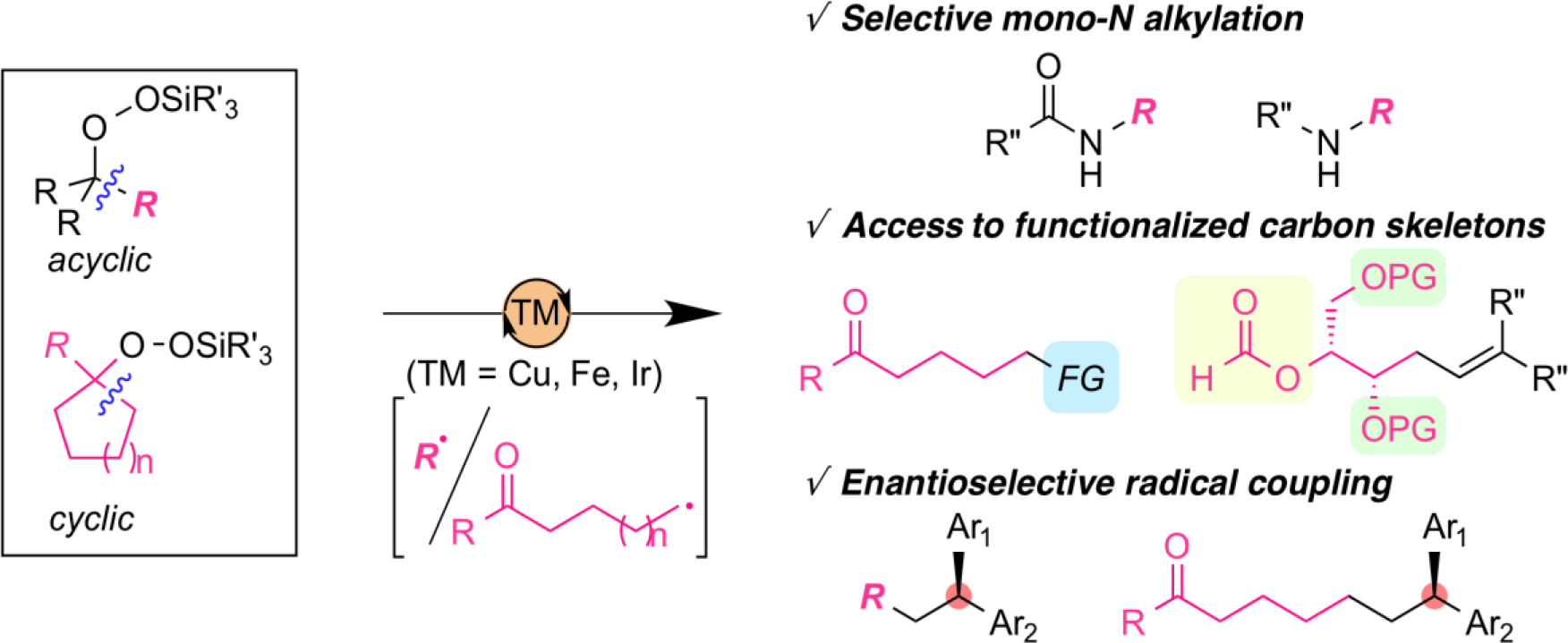
硅烷基过氧化物作为烷基自由基的前体
有机过氧化物,如DTBP(二叔丁基过氧化物),已经广泛用作烷基自由基的前体。然而,通过这种方法产生的自由基种类非常有限,主要产生结构简单的自由基,例:甲基自由基,该方法需要苛刻的反应条件,例如高温。我们课题组最近研究发现,由硅烷基直接连接在过氧键(-O-O-)上所形成的硅烷基过氧化物(ASP),易于制备,且有效的充当自由基前体。这些试剂,在适当的过渡金属催化作用下,在温和的反应条件下,可产生系列带有官能团的烷基自由基。值得注意的是,这一方法的优势在于其诱人的应用前景,如:构建复杂的碳骨架、高区域选择性和高立体选择性碳-碳键的构建。
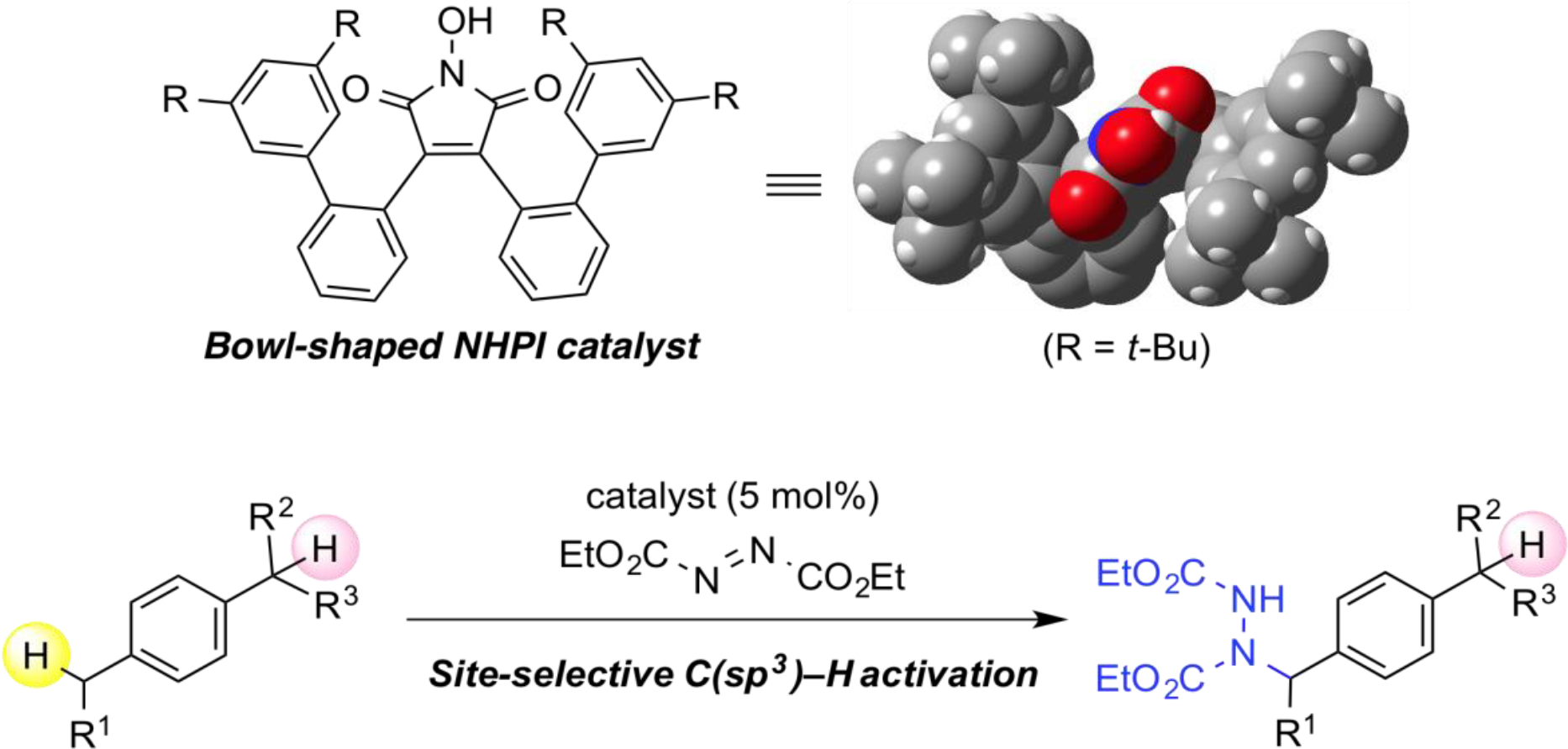
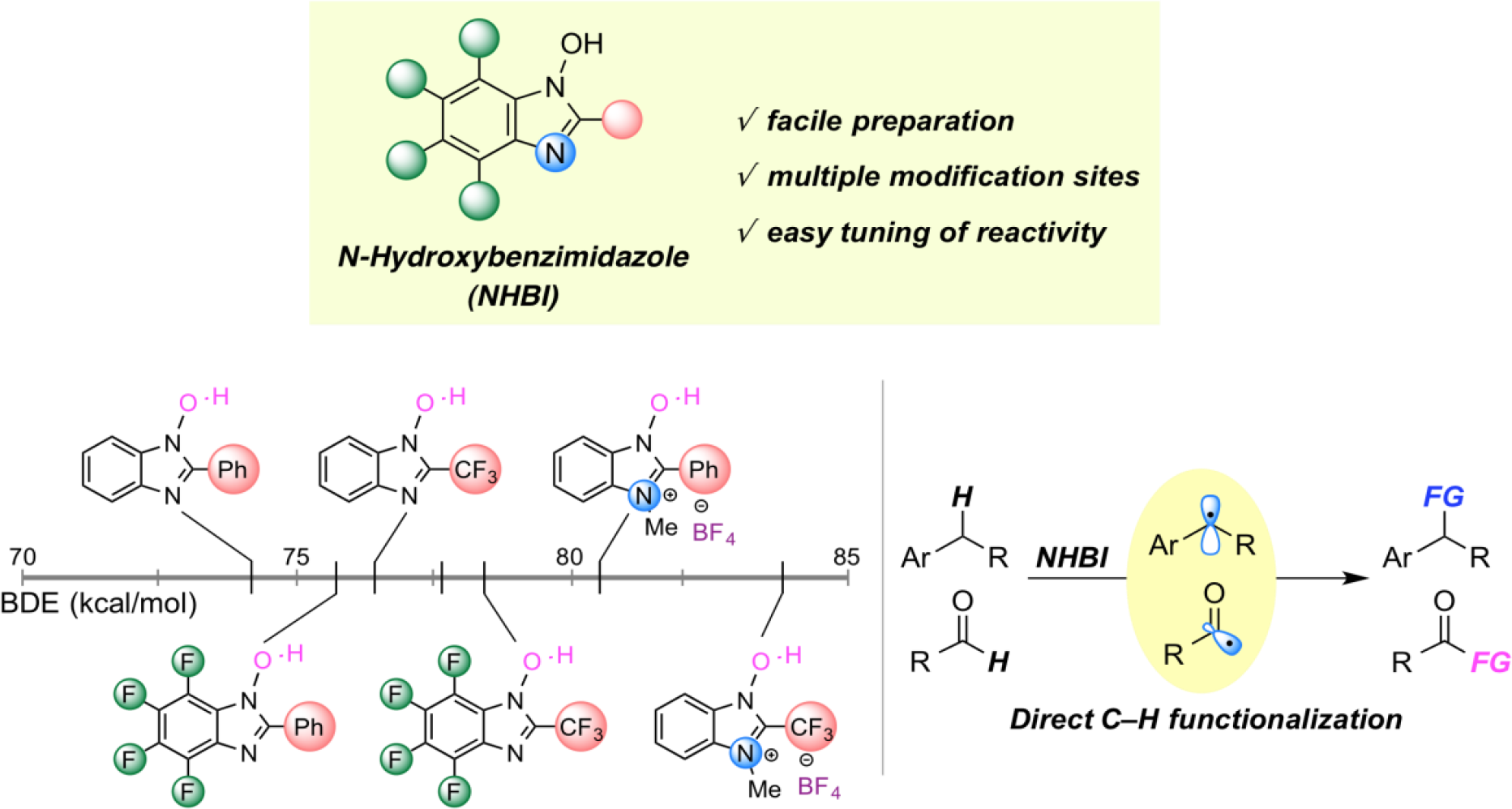
基于C-H键官能团化的N-氧基自由催化剂的设计
碳氢键的选择性的、直接的官能化是有机化学中最活跃的研究课题之一,因为这些策略可以从现成的原料中开发出高附加值的化学品。N-氧基自由基捕捉碳氢键上的氢是简单底物生成烷基自由基的有效方法之一。这种方法的一个缺点是N-氧基自由基在结构上缺乏多样性,极大限制了它们在C-H官能化反应中的适用性。为了开发其作为实用有机自由基催化剂的潜力,我们在原有的分子设计基础上开发了新型N-氧基自由基,并将其应用于独特的C-H官能化反应中。
有机催化化学研究
研究方向
基于我们参与的精密路易斯酸和有机金属催化剂设计研究中获得的成果和信息,我们对有机催化进行了合理的催化剂设计,根据有机催化剂的性能,将其分为四个研究方向:“有机碱催化剂”,“有机酸催化剂”,“有机酸/碱复合催化剂”和“有机自由基催化剂”。
通过本项目的基础研究和应用研究,我们的目标是设计和合成系列高效的有机催化剂,用于包括不对称转化在内的实用的有机合成。
有机碱催化剂
关于有机碱催化剂,我们致力于手性相转移催化剂的设计并进行了以下基础性研究和应用研究。
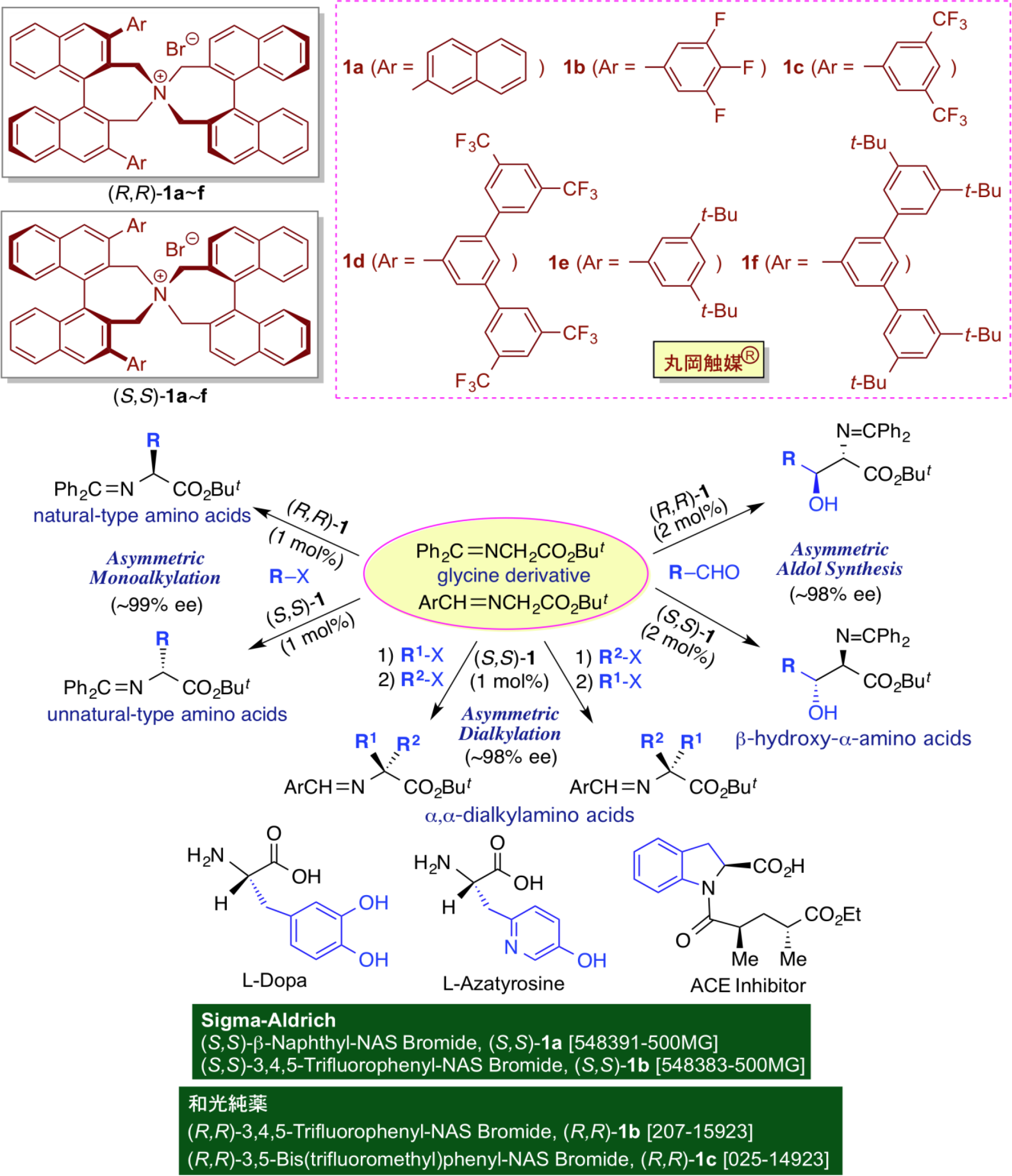
作为相转移催化剂的四烷基铵盐(R4N + X-)因其离子型结构而通常具有一定的水溶性。然而,当烷基链增长时,其脂溶性增加,可溶于有机溶剂。利用该性质作为相转移催化剂,可以在室温、水存在条件下进行各种反应,反应速率有望大大提高。此外,应用于有机合成时,体现出诸多优势,如:实验操作非常简单。基于此,相转移催化反应可以在水溶液中、室温、常压下、开放体系中进行,因此该反应体系易于工业化。然而,设计和制备高效的手性相转移催化剂以应用于不对称合成具有挑战性。目前,金鸡纳碱衍生物是手性相转移催化剂的成功案例,然而,这些手性相转移催化剂常受到催化剂设计和卤代溶剂使用的限制,因此在有机合成反应中的适用性也受到一定限制。为了概念性创新地开发适用于各种不对称转化的手性相转移催化剂,我们通过引入廉价易得的光学纯的(S)-联萘酚和(R)-联萘酚来制备轴手性的相转移催化剂(R,R)-1和((S,S)-1,即Maruoka催化剂“ MaruokaCatalyst®”(Sigma-Aldrich和Wako Pure Chemical Industries有销)。
自此,我们已利用这些手性相转移催化剂开发了多种不对称相转移催化反应。其中,使用MaruokaCatalyst®进行的甘氨酸衍生物的不对称催化烷基化反应可以高效地催化合成光学活性的α-氨基酸,氨基酸衍生物及相关产物,包括天然和非天然氨基酸、氨基醛,氨基酮,氨基醇等。我们利用不对称相转移催化已成功合成了多种具有生理活性的氨基酸衍生物,如:帕金森病的治疗剂,L-多巴,抗生素,L-氮杂酪氨酸,ACE抑制剂等。
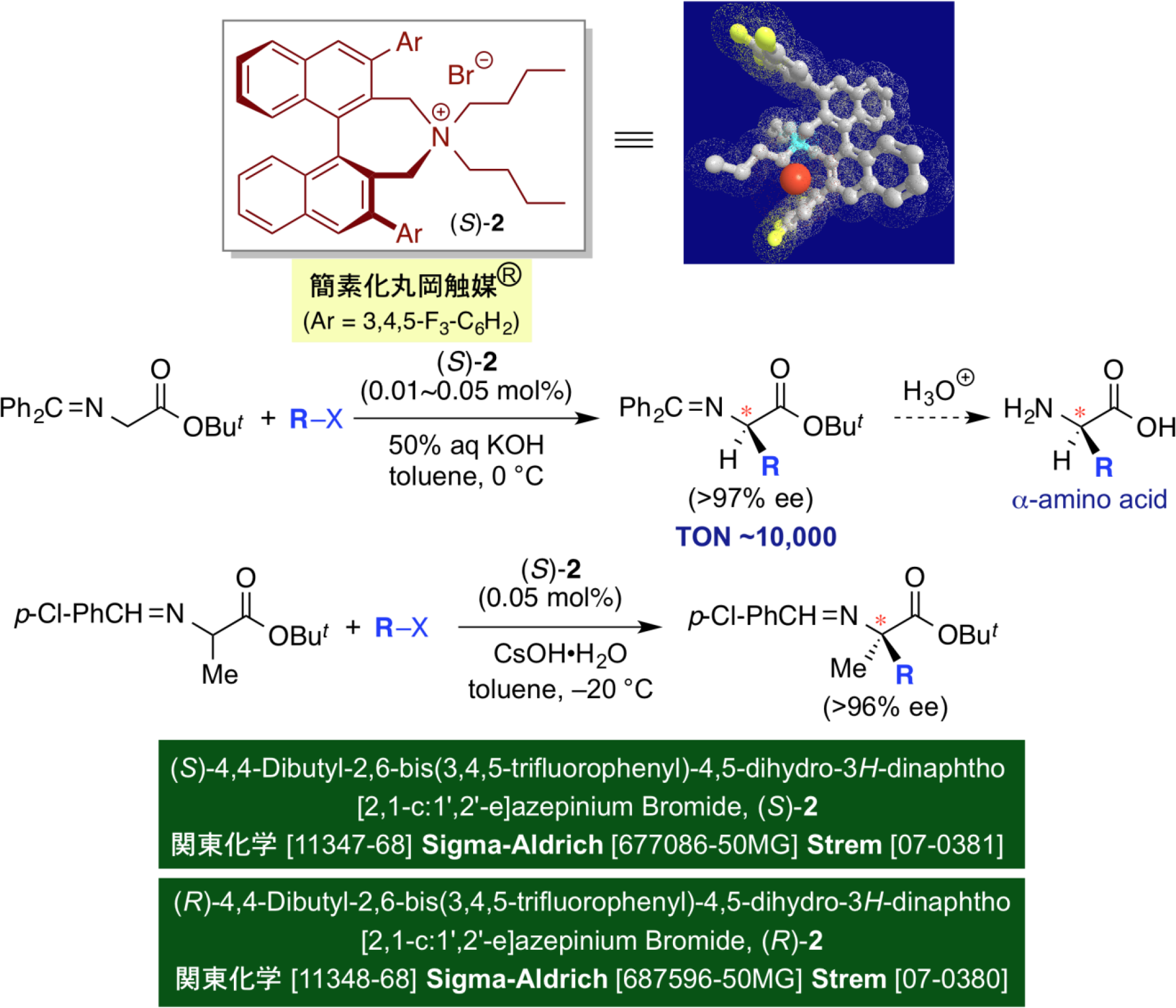
为了进一步实现手性相转移催化剂催化合成非天然氨基酸的产业化,我们重点设计并改造了手性高性能相转移催化剂的结构,开发了简化的手性相转移催化剂。理想情况下,使用一个联萘骨架比采用两个更可取。因此,我们广泛研究了新型的、简化的单联萘骨架的相转移催化剂的设计,并引入组合设计方法,最终开发了催化剂(S)-2,这也是我们开发的最好的催化剂之一。研究发现,仅需0.001mol%的催化剂(S)-2就能够顺利实现甘氨酸衍生物的不对称烷基化,且显示出较高的对映选择性。此外,将该方法应用于α-烷基氨基酸衍生物,实现了光学活性α,α-二烷基氨基酸的不对称催化合成方法。关于该手性催化剂,我们获得了注册商标“Simplified Maruoka Catalyst®(简化的Maruoka催化剂)”,目前由Sigma-Aldrich,Strem和Kanto Kagaku进行销售。通过应用这种高活性的手性催化剂,我们已在长濑和岸田化学成功实现了各种非天然氨基酸类药物中间体的产业化。

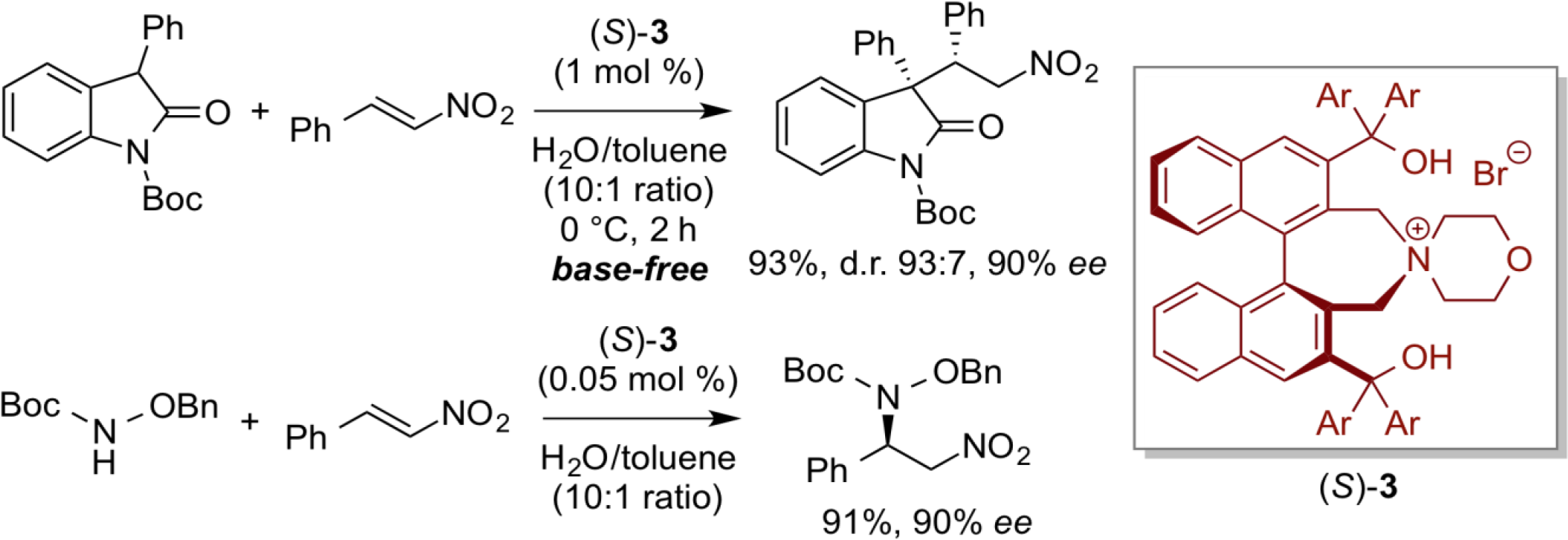
上述以季铵盐作为相转移催化剂的反应体系中,碱(如氢氧化钾)的添加对促进相转移催化反应起着至关重要的作用。然而,手性相转移催化体系也可以在不添加碱的中性条件下进行。在反应体系中,手性双功能相转移催化剂(S)-3参与的相转移催化反应,仅需在水中加入很少量的有机溶剂来溶解有机底物与催化剂。因此,这种中性反应条件实际上是对环境友好,且实用的反应体系。
有机酸催化剂
有机酸催化剂催化的不对称合成中,氢键供体的酸性是实现反应的关键。适当使用它们的必要性源于对光学活性醇,硫脲和磷酸的选择。有趣的是,仅有很少的报道使用最常见的弱酸---羧酸,作为有机酸催化剂。这与最重要、最实用的有机酸/碱催化剂脯氨酸利用羧酸作为其酸催化剂位点形成鲜明对比。在有机酸催化剂的研究中,使用羧酸的困难归因于以下两点:(1)难以在羧酸周围构建有效的不对称环境,(2)羧酸作为酸催化剂的反应性较低。为了克服这些困难,我们引入了催化剂4(二羧酸轴手性催化剂),该催化剂中2个羧酸的距离可以非常好的形成分子内氢键,从而表现出与其它有机酸催化剂明显不同的独特性质。
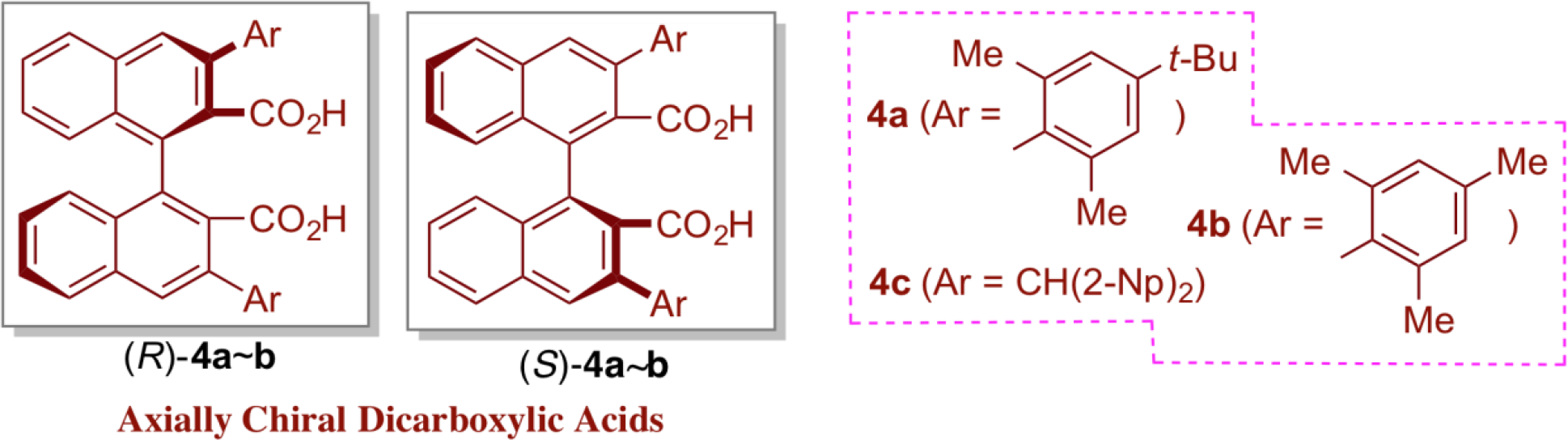
重氮化合物的曼尼希型加成反应
我们研究发现,重氮乙酸酯和重氮磷酸酯在轴手性二羧酸催化剂(R)-4a的作用下,与N-Boc亚胺反应,能够高对映选择性地获得相应的曼尼希型产物。以此获得的光学活性的α-氨基-β-重氮酯易于转化为相应的药理活性中间体β-氨基酸和氨基磷酸酯。
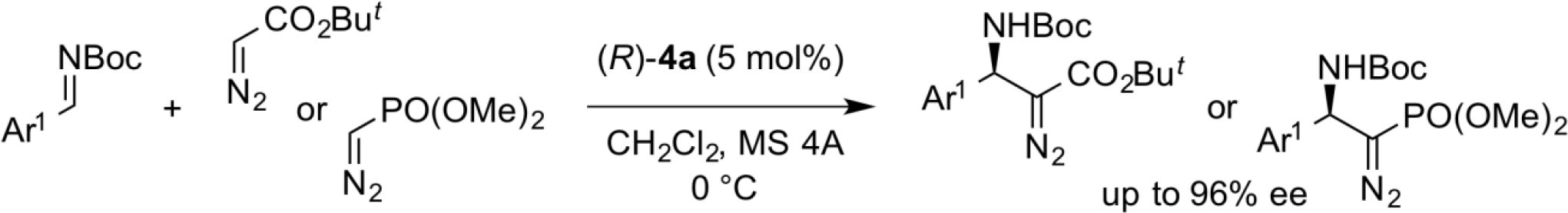
反式选择性不对称叠氮化反应
在上述的曼尼希型反应中,将作为反应底物的重氮乙酸酯换成重氮乙酰胺,氮杂环丙烷化反应过程具有较高选择性。尽管常规的手性路易斯酸催化剂表现出顺式选择性,但本反应优先提供了反式异构体。
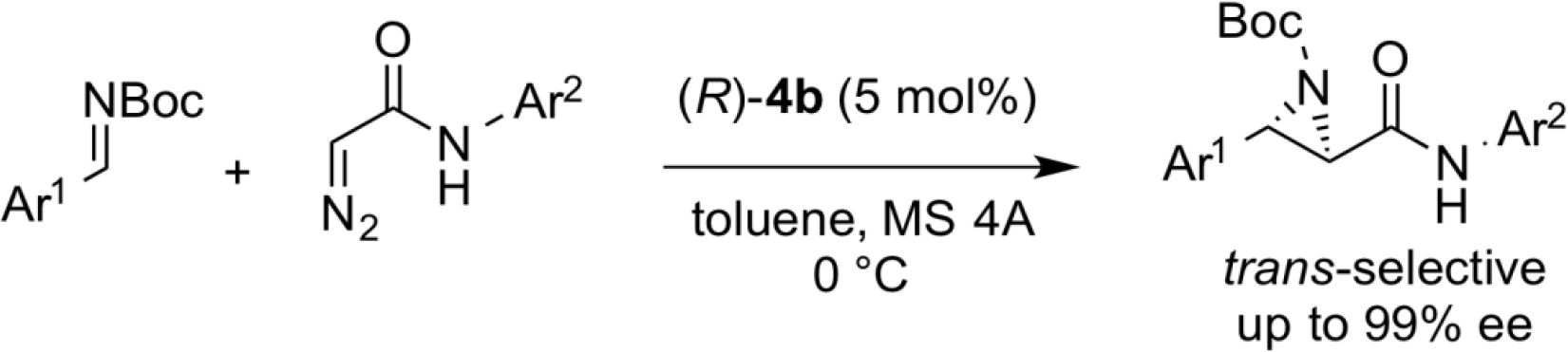
亚氨基氮杂胺反应
我们还开发了氮杂烯胺的不对称催化加成反应,由相应的N, N-二烷基肼和醛与N-Boc亚胺形成,如下所示。该不对称反应的特征在于其优异的立体选择性和底物通用性,这是现有其它催化剂体系无法实现的。
含硼有机酸催化剂的化学
由手性二醇5和2-硼苯甲酸6制备的手性酸催化剂(S,S)-7表现出独特的反应活性,实现了N-Boc亚胺与重氮乙酰胺进行的反式选择性不对称氮杂环丙烷化,获得了较好的非对映和对映选择性。
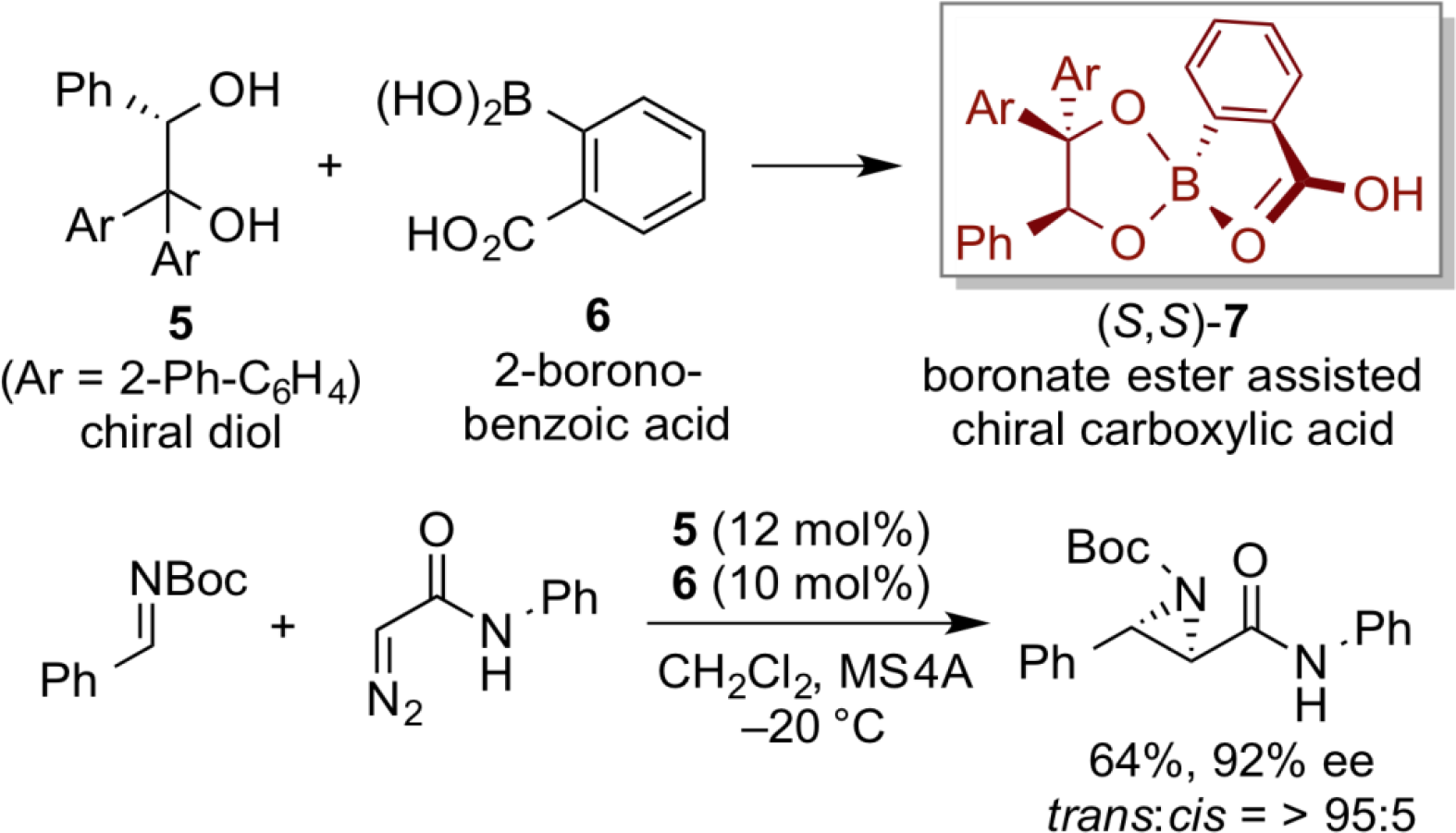
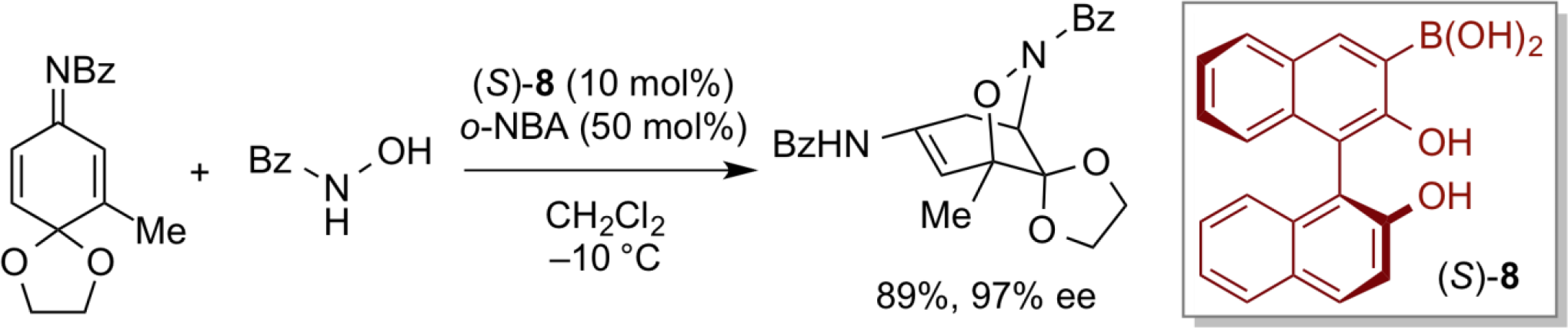
基于光学纯的联萘酚的手性硼酸骨架,我们设计合成了另一类手性有机酸催化剂(S)-8, (S)-8催化剂高对映选择性地实现了异羟肟酸与醌亚胺缩酮的氮杂共轭加成反应。
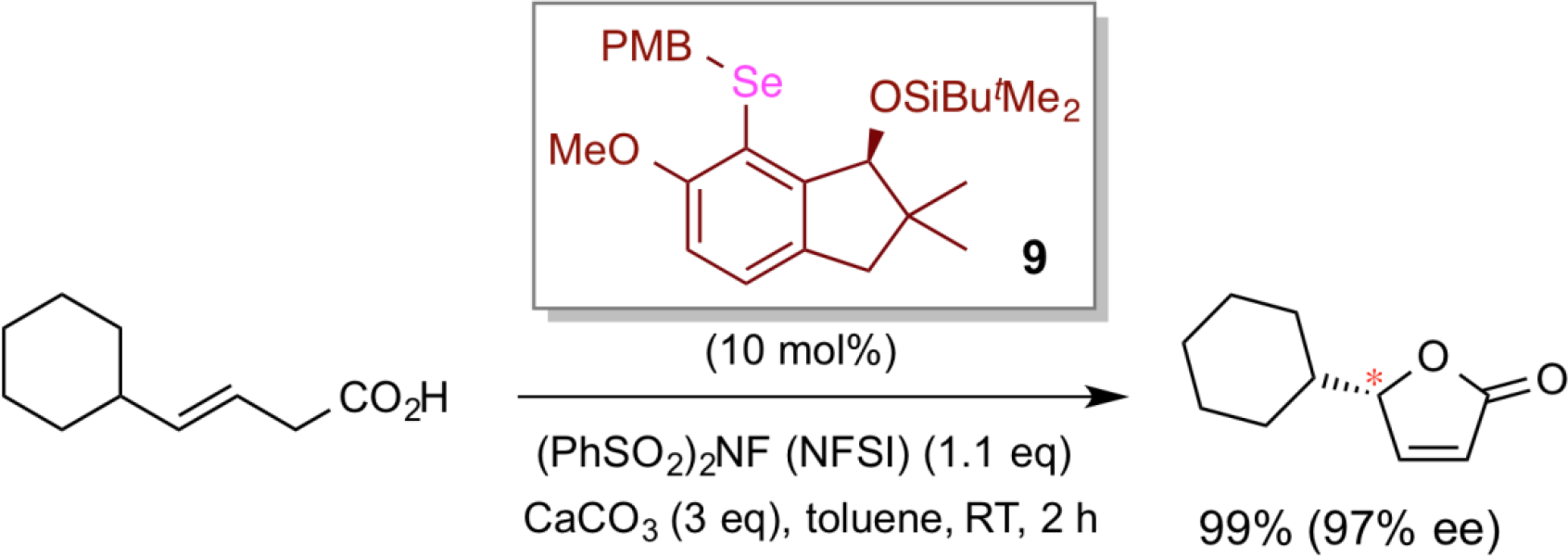
近年来,作为一项全新的研究进展,我们成功设计了一种新的亲电硒化合物,一种高效的手性有机π-酸催化剂9。该亲电硒型手性π-酸催化剂9以优异的对映选择性成功地实现了β, γ -不饱和羧酸的不对称内酯化。
有机酸碱催化剂
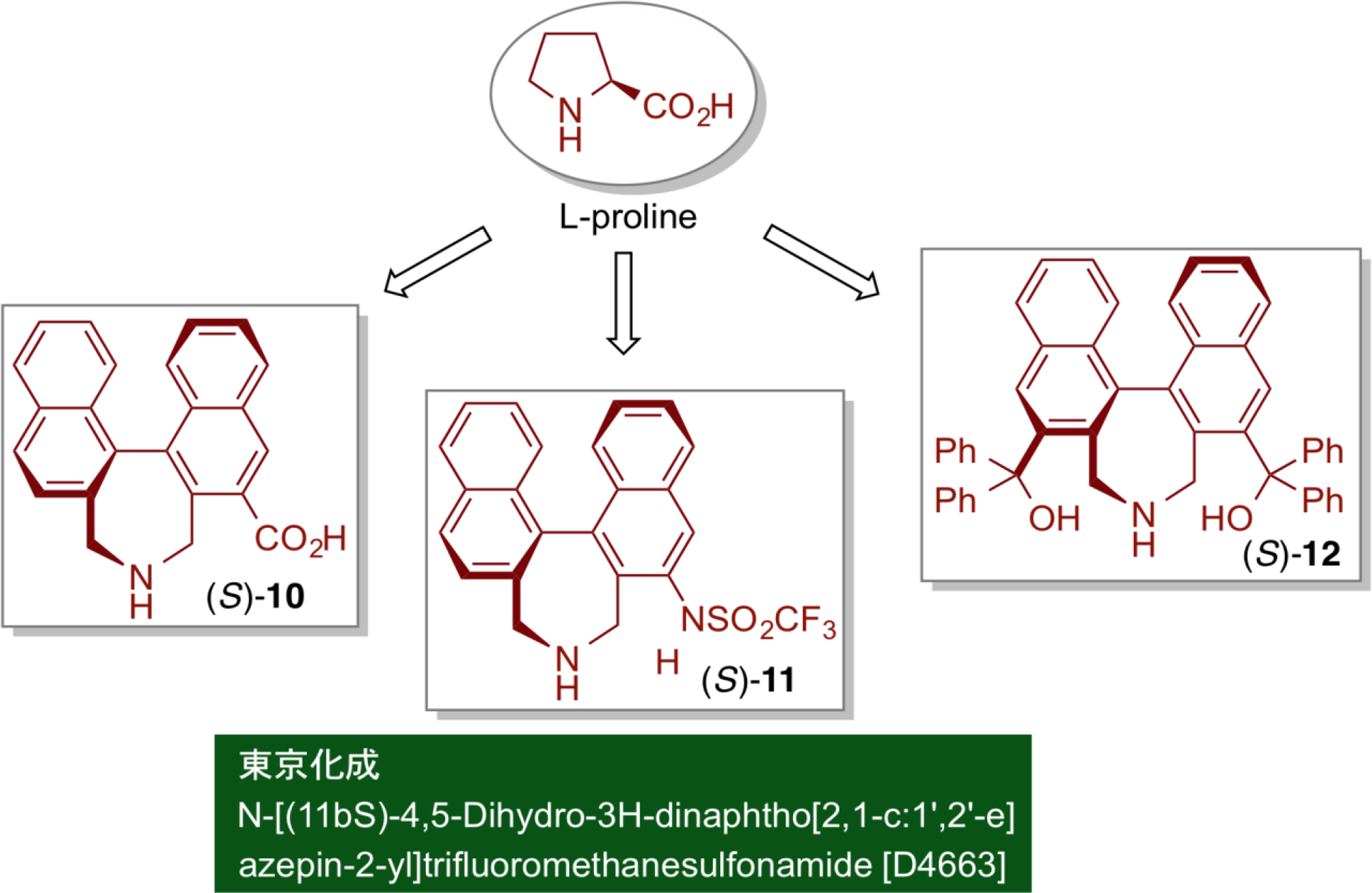
近年来,已广泛研究的有机催化剂通常来自天然产物,如:脯氨酸、其他氨基酸、金鸡纳生物碱。这些催化剂具诸多种优势,如:起始原料易得、易于制备有机催化剂。到目前为止,其高效性已体现在各种不对称催化反应中。 然而,由于催化剂的结构在很大程度上受限于起始原料的天然产物的结构,因此在预期反应的有机催化剂的合理设计上受到极大限制。 因此,我们引入了手性联萘结构作为催化剂的核心骨架,该手性骨架易得且易于结构修饰。通过我们的策略精确设计合成的手性有机催化剂10, 11和 12,显示出独特的反应性活性和选择性,这是常规有机催化剂难以做到的。
直接不对称羟醛反应
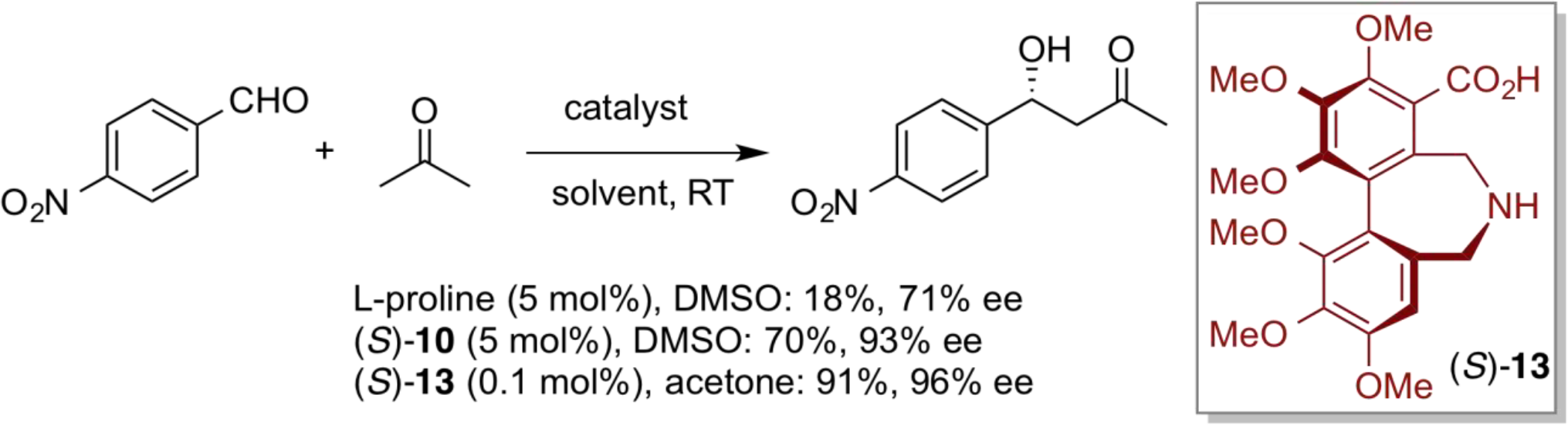
通过将仲胺基和羧基引入具有轴手性的联萘核心骨架,制备了新型非天然氨基酸(S)-10。新设计合成的(S)-10的手性效率通过应用直接不对称醛醇缩合反应来进行评估。脯氨酸催化剂在丙酮和对硝基苯甲醛的直接不对称醛醇缩合反应中显示出非常低的反应活性和中等的对映选择性。与之形成鲜明对比的是,在相似的反应条件下使用(S)-10可获得良好的收率和高对映选择性。此外,具有六个给电子的甲氧基取代基的光学纯的联苯衍生催化剂(S)-13显示出异常高的反应活性,且以非常低的催化剂负载量(0.1mol%)获得较高的化学收率和优异的对映选择性。
反式选择性不对称曼尼希反应
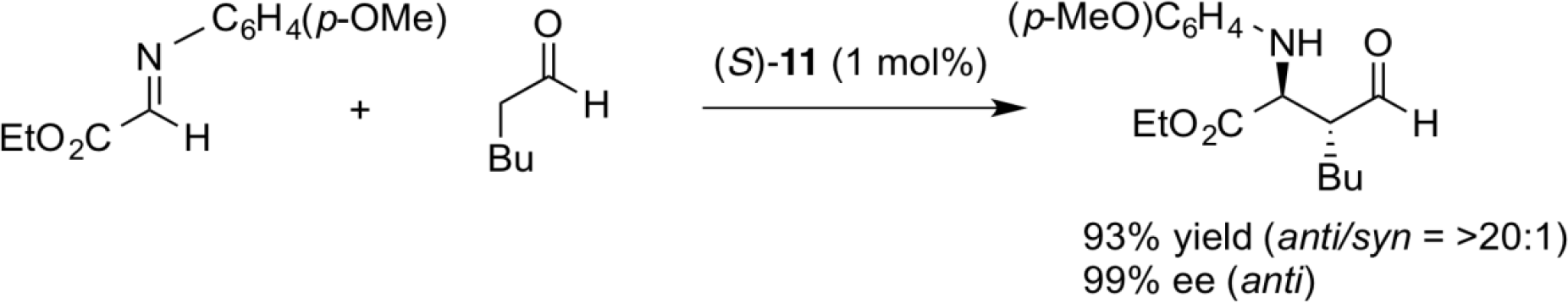
曼尼希反应是一类通过构建碳-碳来制备β-氨基羰基化合物的重要反应。 近年来,已经报道了许多使用各种有机催化剂的直接不对称曼尼希反应。 脯氨酸作为有机催化剂时,通常通过具有s-反式构象的烯胺中间体,以高对映选择性获得顺式曼尼希产物。与之形成鲜明对比的是,我们新设计的氨基磺酰胺催化剂(S)-11通过具有s-顺式构象的烯胺中间体,得到了具有高对映选择性的相反的反式曼尼希产物。 即使在非常低的催化剂负载量(~0.2 mol%)下,该反应也进行得非常顺利。该催化剂结构稳定,易于回收并可重复使用。 该催化剂现在东京化学工业公司销售。
直接不对称曼尼希反应
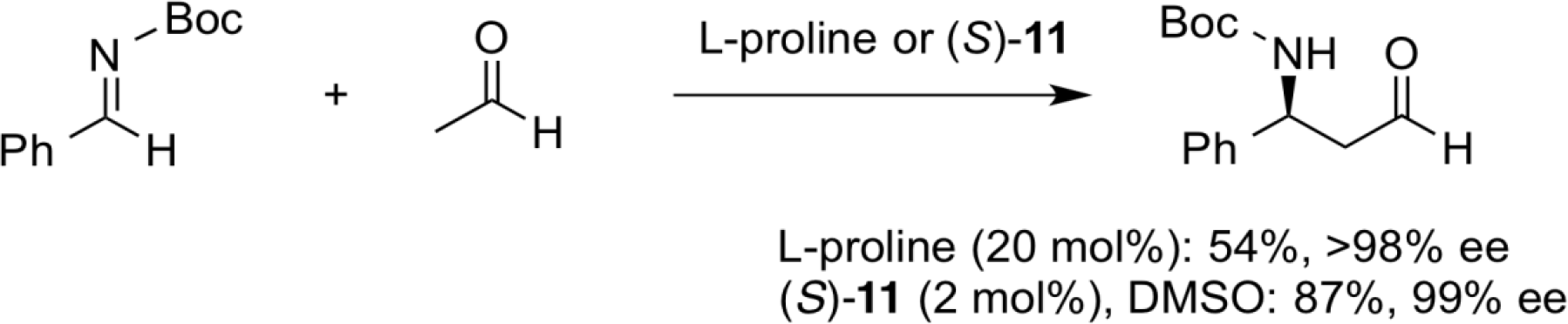
在高反应活性乙醛的直接不对称曼尼希反应中,诸如羟醛缩合反应的副反应会导致曼尼希产物的产率降低。 相比之下,我们的仲氨基磺酰胺催化剂(S)-11在低催化剂负载量的条件下即可得到相似的优异的对映选择性。
直接不对称羟胺化反应
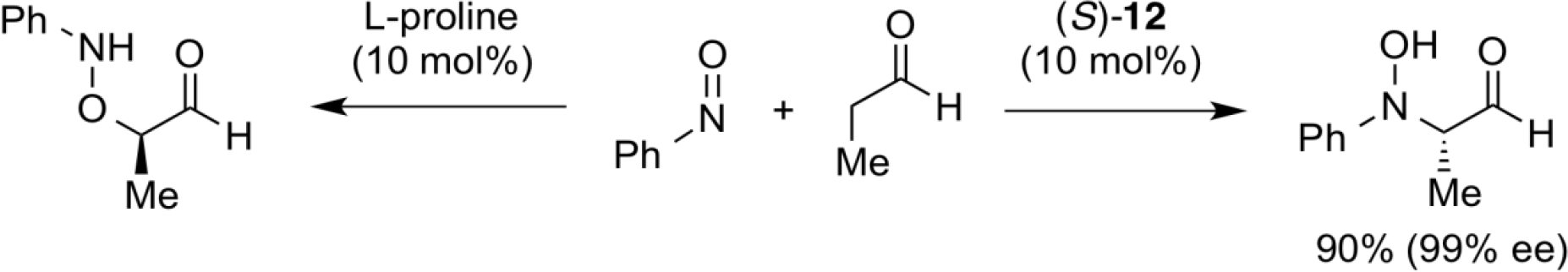
醛与亚硝基化合物在脯氨酸催化下加成反应,亚硝基化合物的N=O基团的氧侧成键形成氨基羟基化合物。而使用含有大位阻叔醇基团的联萘骨架改造的仲胺催化剂(S)-12,催化该加成反应时,在N=O基团上的区域选择性发生了逆转,发生了直接的不对称羟胺化反应,且具有较高对映选择性。
在不对称催化研究中,两种对映异构体产物可以分别通过相应的对映异构体催化剂来催化实现。因此,如果能够通过廉价易得的手性原料,以简短的合成步骤,获得两个不同的有机催化剂,并成功应用于两种对映异构体产物的合成中,尤其是应用在大量的手性功能材料的高效合成中,将会是一种非常高效且实用的方法,。六元顺式二胺型双功能有机催化剂15和16的设计,证明了我们的设想。与常规的有机催化剂不同,这种六元环的顺式二胺型双官能有机催化剂的特征在于,可以从简单易得的手性化合物14为原料,经3步反应产生两种不同的手性双官能有机催化剂15和16。将这两种不同的双官能有机催化剂分别用于直接不对称羟醛缩合反应时,两种对映体羟醛缩合产物都能获得较高的对映选择性。
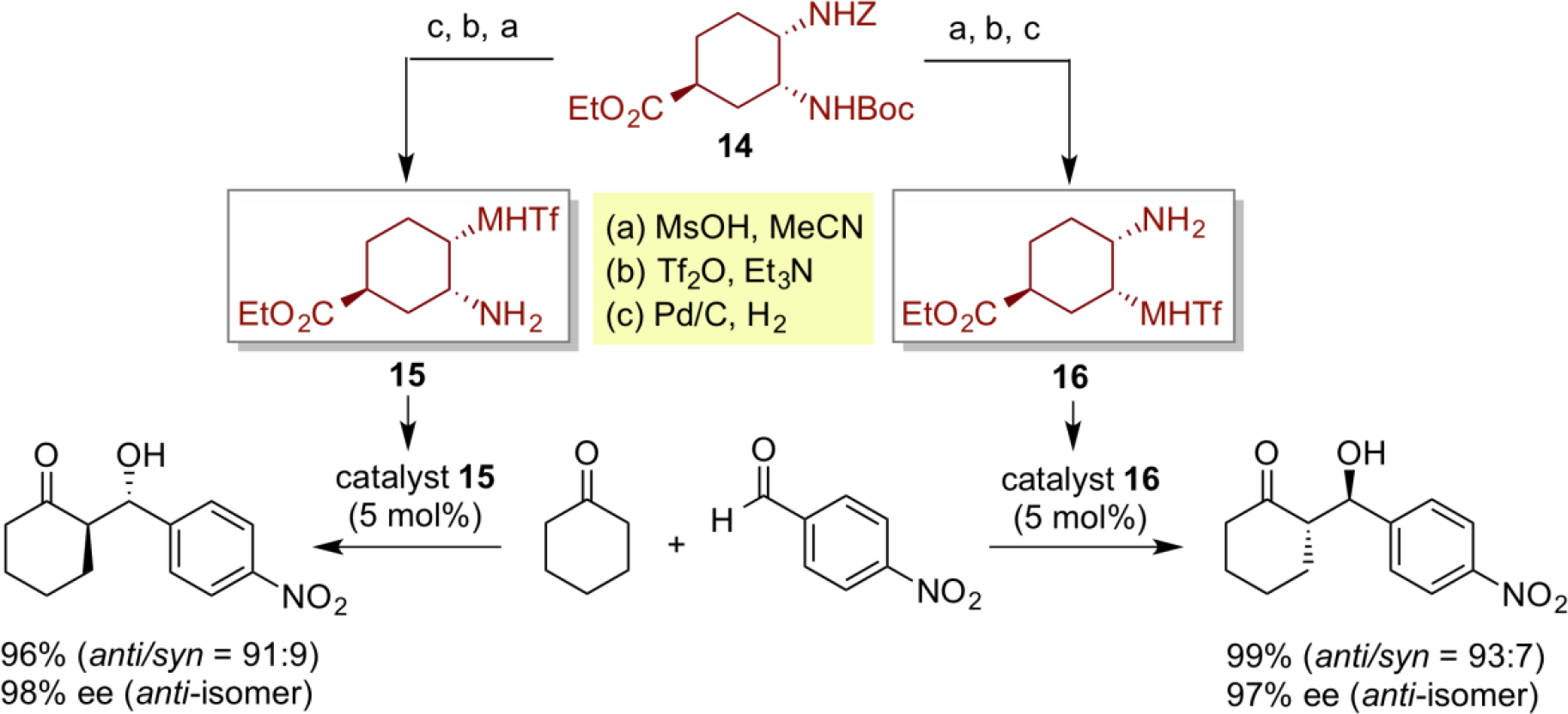
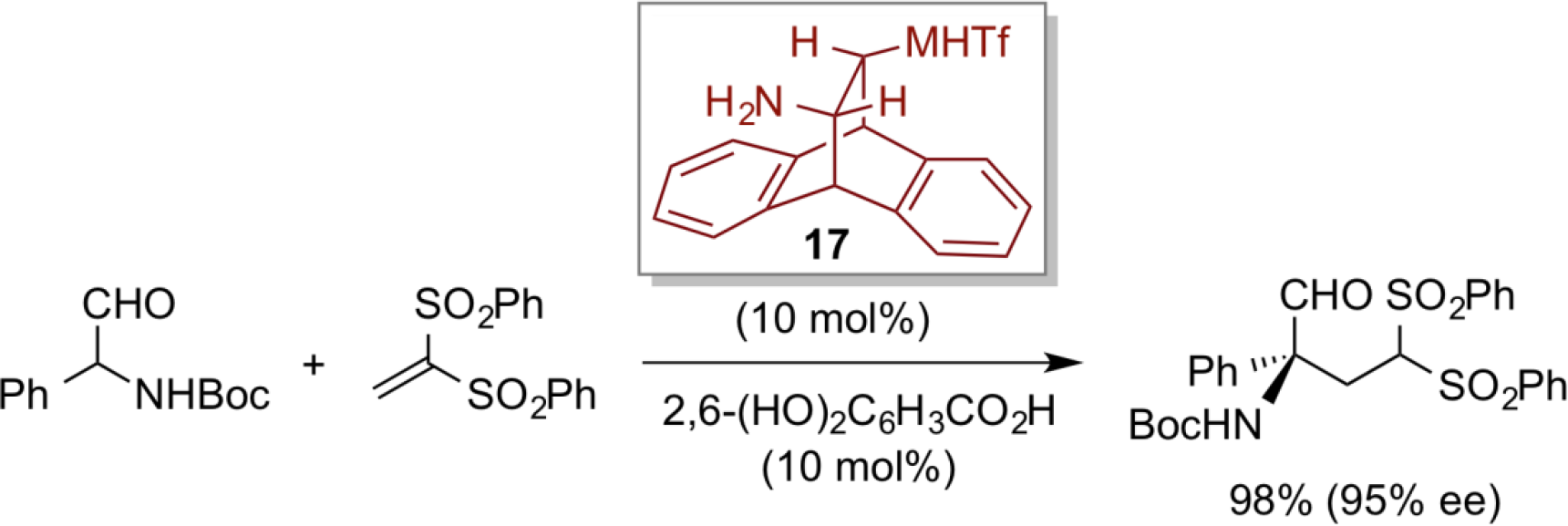
另外,我们设计了衍生自蒽的反式二胺型双官能有机催化剂17,并成功地用于α-氨基醛与乙烯基砜底物的高对映选择性共轭加成。
有机自由基催化剂
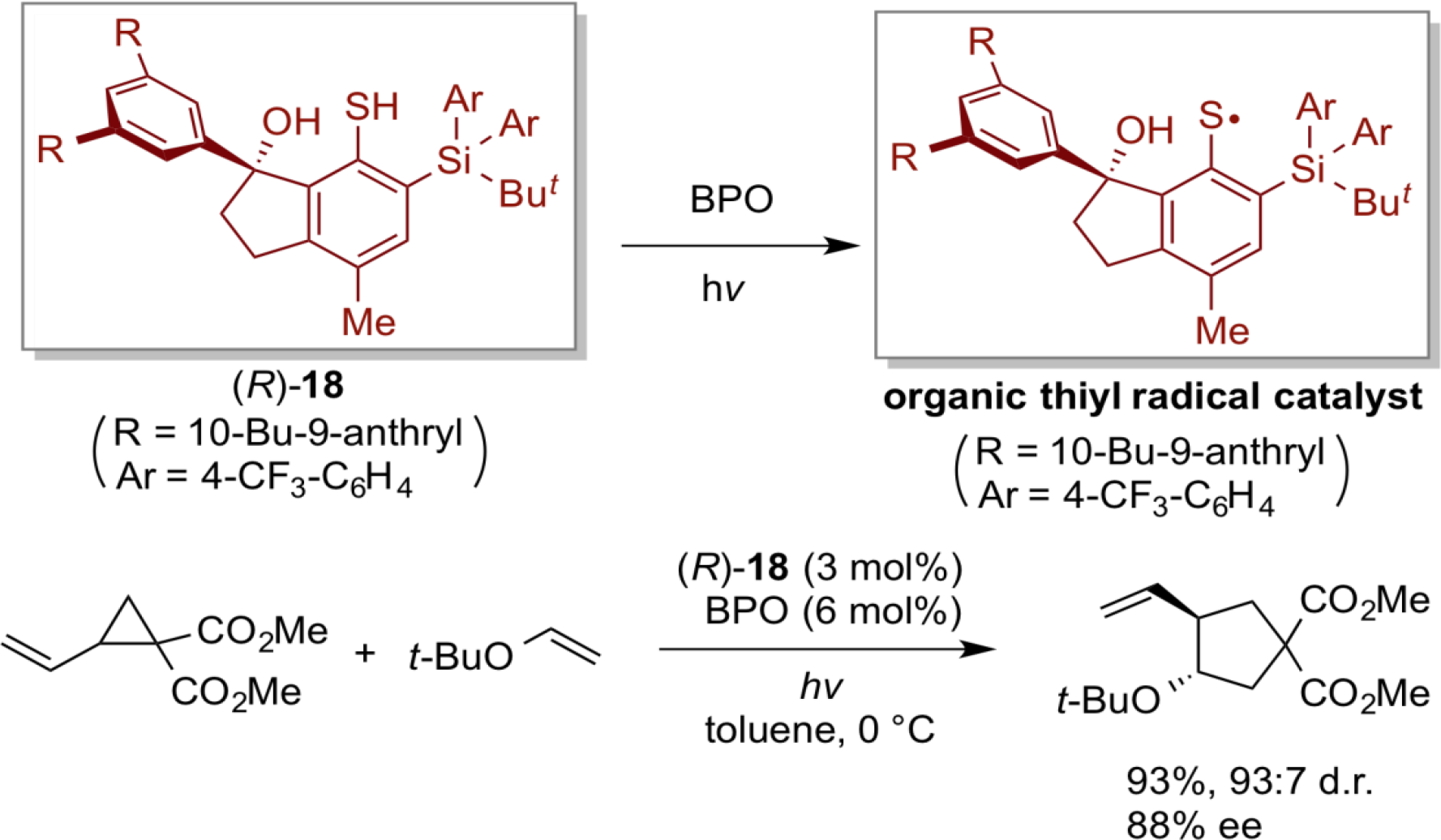
自由基是一种非常活泼的化学物质,可实现普通离子反应难以完成一些特殊反应,因此,在反应中引入自由基物质具有诱人的前景。然而,基于有机自由基催化的自由基反应的研究发展远远滞后于其它有机催化的领域。为了开发我们的有机自由基化学,我们着力于开发新型的能够从相应的二硫键或硫醇生成的有机硫自由基,并将这种有机自由基物质用于新的有机自由基反应的开发中,其中手性硫自由基起着活性物质的作用。研究表明,在光照条件下下,由具有手性茚醇骨架的手性硫醇(R)-18和过氧化苯甲酰(BPO)生成的手性有机硫自由基实现了乙烯基环丙烷和烯烃之间的不对称自由基环化,从而以高收率、高立体选择性构建了各种手性多取代的环戊烷。
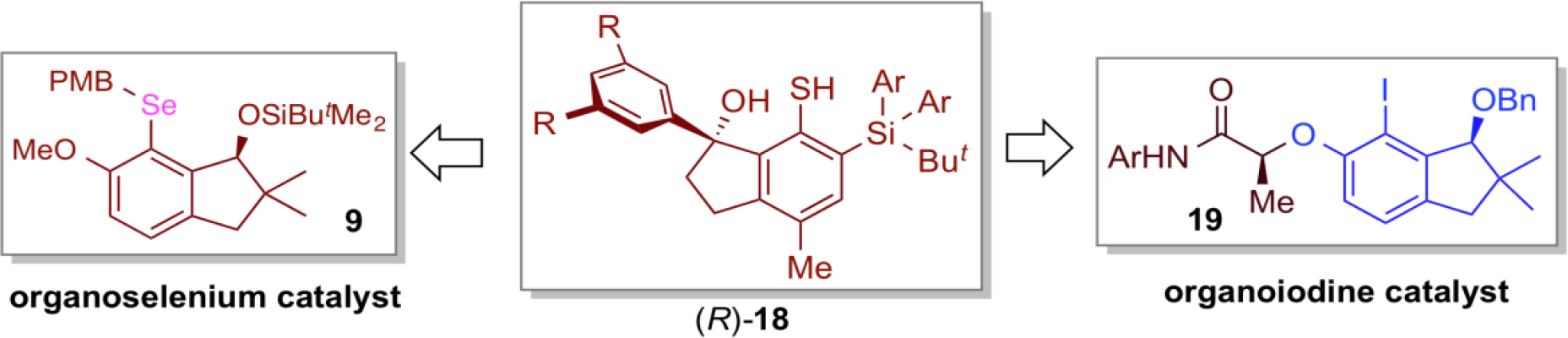
在这项研究中构建的手性茚醇骨架是其它有机分子催化剂设计中的重要优势结构。事实上,具有相似关键骨架的有机硒催化剂9和有机碘催化剂19分别在β, γ -不饱和羧酸的不对称内酯化及酚的不对称去芳香化反应中,显示出较高的不对称诱导作用。
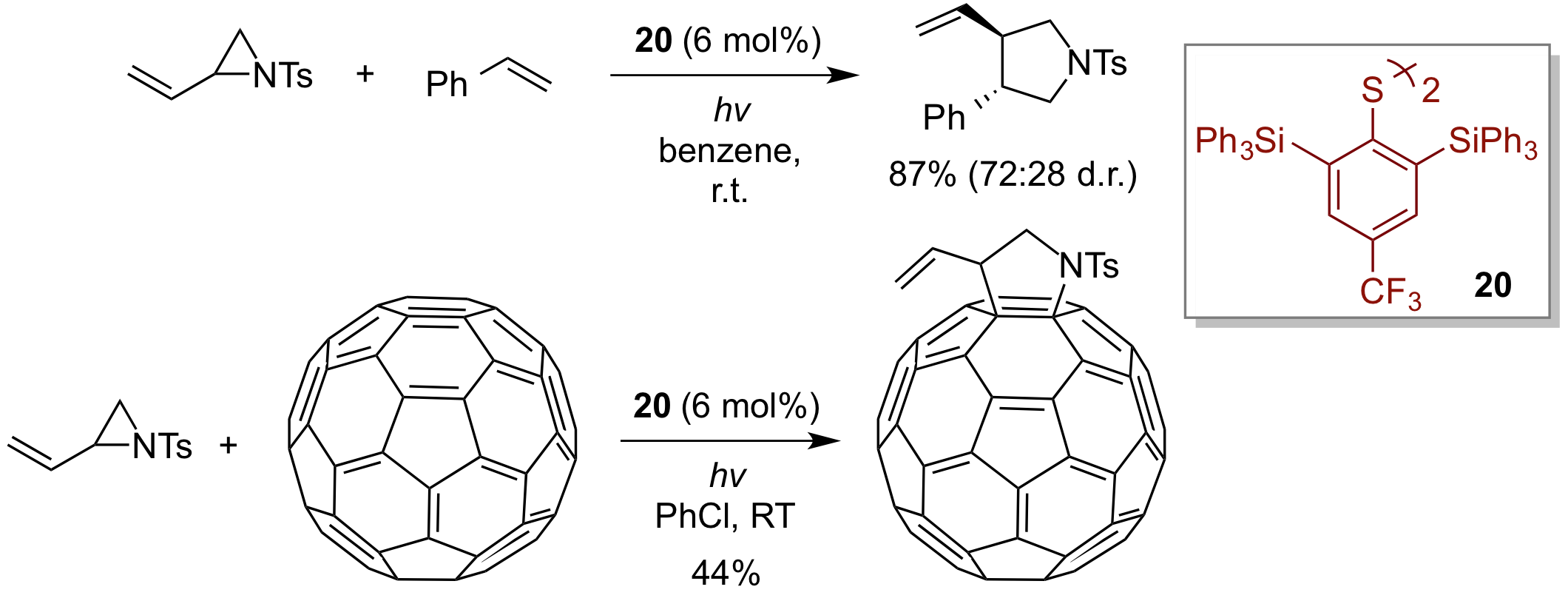
此外, 我们还成功开发了一种具有较大空间位阻的双硫的有机硫催化剂20.在其介导下,用乙烯氮杂环丙烷(一种含氮三元环化合物),与烯烃发生自由基环化反应。该策略已经在富勒烯的的官能化研究中得到很好的应用。
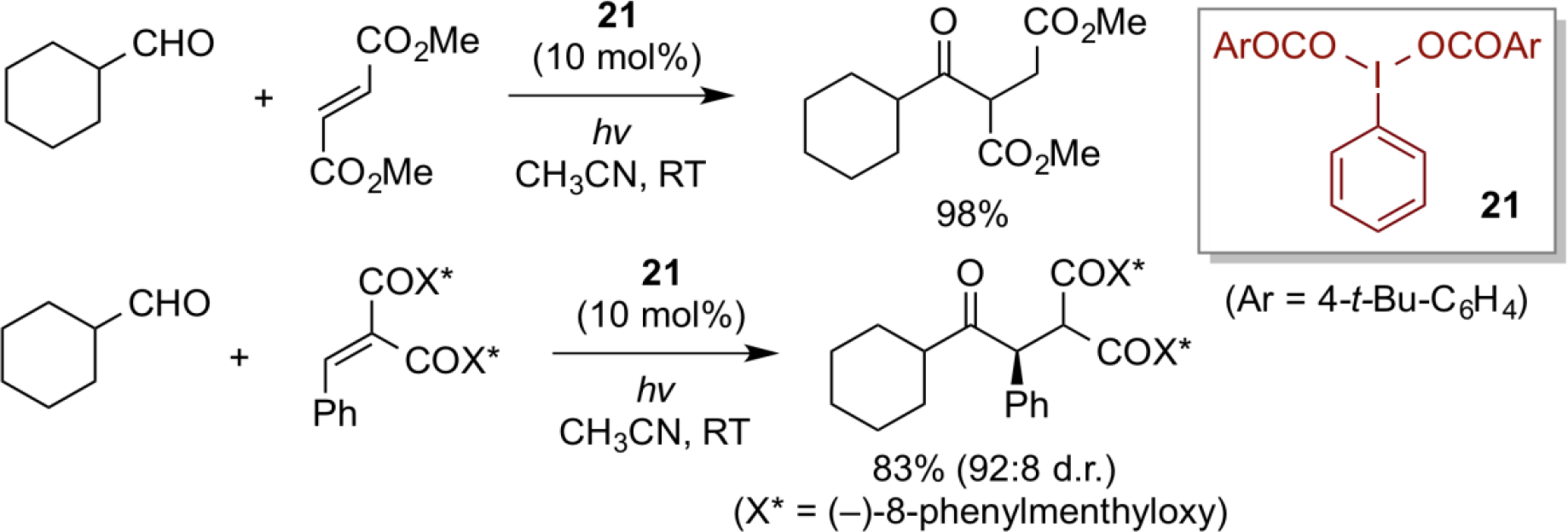
线性醛(RCH2-CHO)的直接酰基自由基的形成,以及后续与缺电子烯烃进行的加氢酰化反应,可以通过各种类型的金属和非金属催化剂/试剂来实现。然而,与之形成鲜明对比的是,由于支链醛形成的酰基自由基易发生脱羰而形成烷基自由基,目前尚未出现使用支链醛进行加氢酰化反应的成功实例。在此,使用高价碘(III)催化剂21,利用可见光光解,可以非常温和地将各种支链醛转化成酰基自由基,进一步与缺电子的烯烃反应,构建相应的加氢酰化产物。这种方法的另一个特征是使用催化量的高价碘(III)试剂,这是高价碘化学中生成自由基的罕见例子。引入含有(-)-8-苯基甲基的光学纯的不饱丙二酸酯衍生物,可以实现较高非对映选择性的酰基自由基的加成反应。
 pagetop
pagetop
