研究内容
ものづくりの基盤技術である有機合成化学において、高反応性活性種を自在に操り、有用分子の合成に役立てることは、豊かな社会を築き上げるための第一歩である。このような命題に対し、当研究室では、有機分子のデザインに基づいた活性種の反応性制御に焦点を当て、これまでにない新たな分子触媒の創製およびそれらを利用した画期的な新方法論の確立を目指し、日々研究を行っている。
現在の研究
新たな有機ラジカル発生法の開発
ラジカル種はこれまで精力的に研究されてきたイオン種(アニオン、カチオン)を用いる反応とは一線を画す特異な反応性・選択性を示すことから、強力な有機合成ツールとしての利用が期待されている。一方で、高い反応性を有するラジカル種を生成する実用的な手法が限られていることから、その進展はイオン反応に比して大きく後れを取っているのが現状である。当研究室では、多様なラジカル種を穏和な条件で発生させ、種々の結合形成反応へ利用することを目的に、以下の新規ラジカル生成法の開発に取り組んだ。
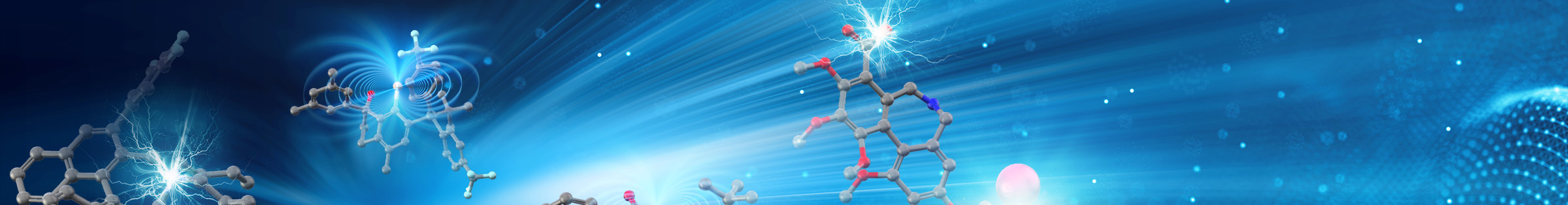
アルキルシリルペルオキシドのアルキル前駆体としての利用
DTBP (di-tert-butyl peroxide) 等の有機過酸化物は、弱い酸素–酸素結合の開裂を起点とする分解過程を経てアルキルラジカルを生じることが知られている。しかしながら、この手法で発生させることのできるラジカル種はメチルラジカル等の極めて単純なものに限られており、その発生法も高温等の過酷な反応条件を必要としていた。我々は最近、過酸 (-O-O-) 構造にシリル基が直接置換したアルキルシリルペルオキシド (ASP) が、調製、取り扱い容易なアルキルラジカル前駆体として効果的に機能することを見出した。適切な遷移金属触媒の存在下、穏和な条件で円滑に進行する本手法は、様々な官能基を有する多様なアルキルラジカル種の生成にとどまらず、複雑な炭素骨格の構築や高立体選択的な炭素–炭素結合形成といった高難度の分子変換にも適用可能であることを明らかにしている。
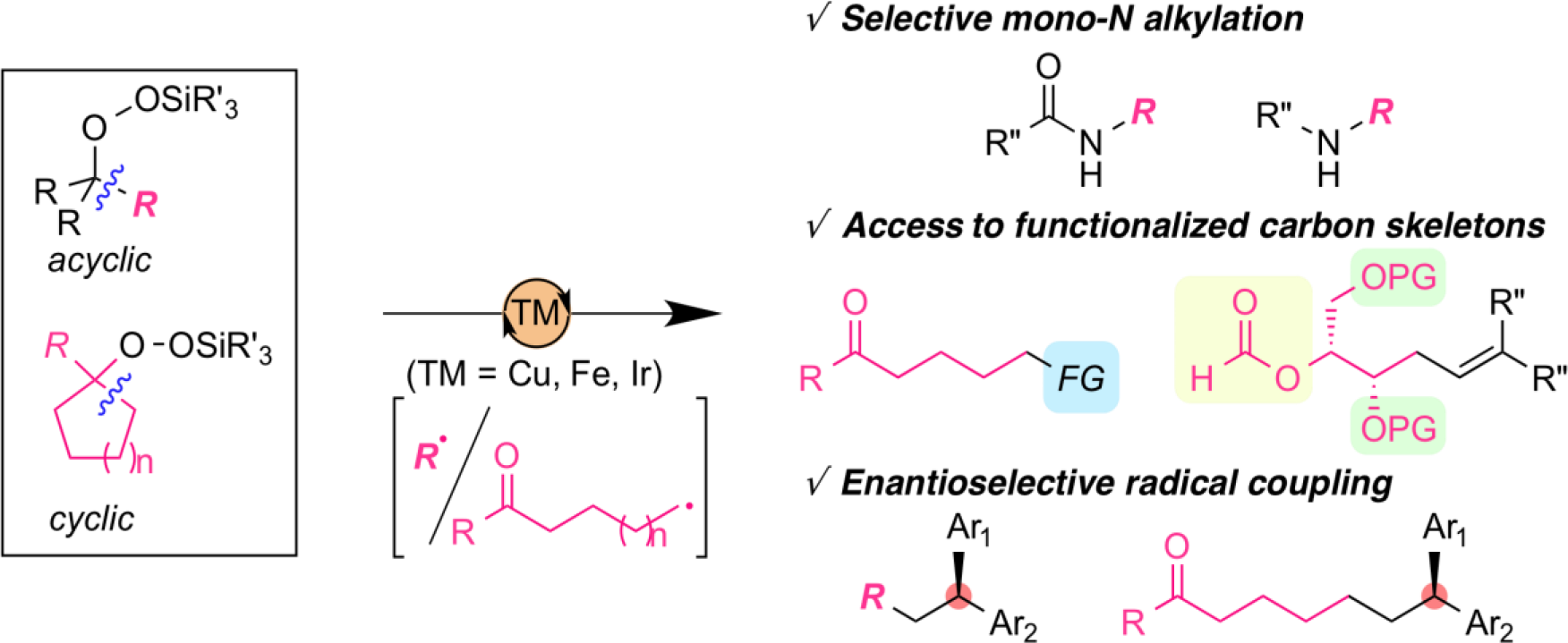
N-オキシルラジカル触媒の分子設計による反応性・選択性制御
有機分子に遍在する炭素–水素結合の選択的な活性化を鍵とする分子変換は、入手容易な原料から効率的に高付加価値化合物を合成できることから、現代の有機合成化学における最も重要な課題のひとつである。炭素–水素結合をラジカル的に活性化する有力な手法として、N-オキシルラジカル種の水素引き抜きを利用したアルキルラジカル生成法が報告されているが、この手法で用いられるN-オキシルラジカルは構造多様性に乏しく、これらの分子設計に基づく反応性・選択性の向上を目指した取り組みは未だ発展途上と言える。我々は、N-オキシルラジカルの有機ラジカル触媒としての潜在性を最大限に引き出すべく、以下の様な独自の分子設計に基づく新規有機ラジカル触媒を創製し、これらを活用した特色ある直截的C–H官能基化反応の開発を行っている。
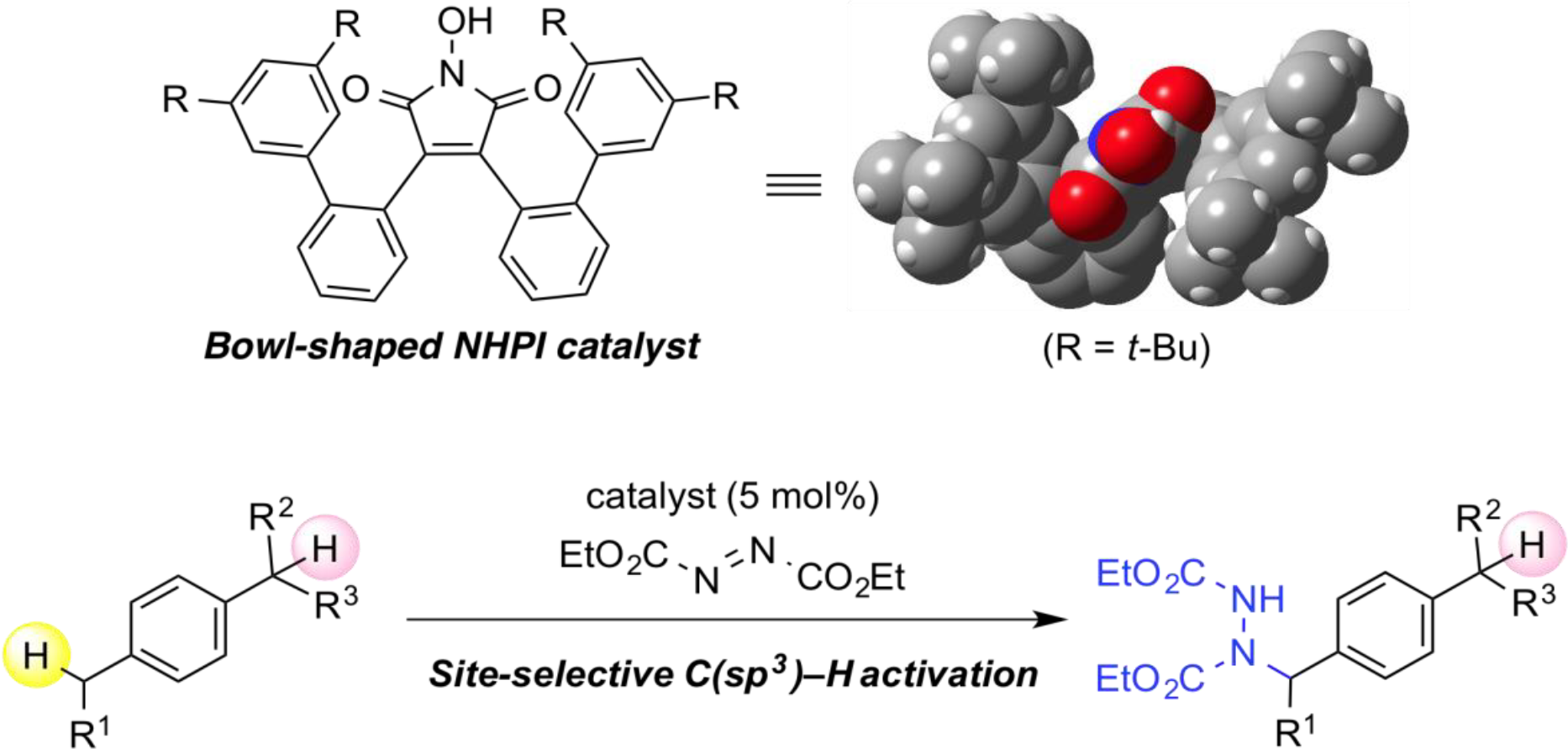
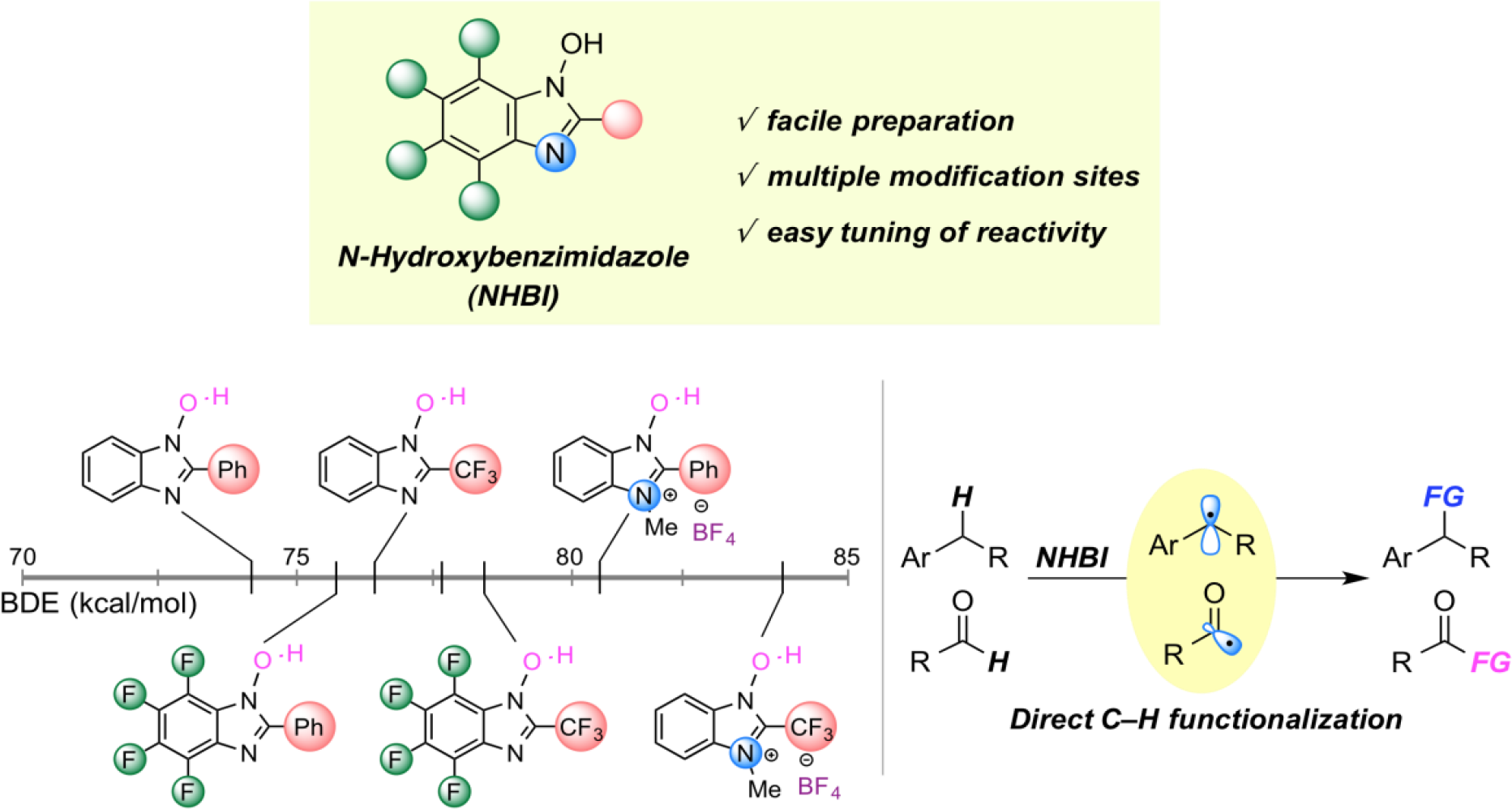
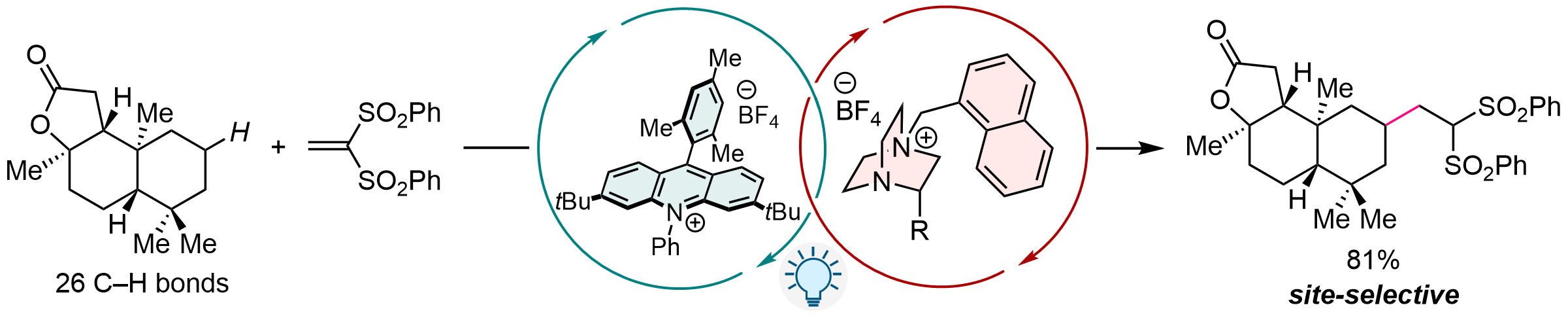
カチオン性DABCO型触媒を用いた可視光駆動型水素原子移動反応の開発
可視光によって駆動する水素原子移動 (hydrogen-atom transfer, HAT) 反応は、穏和な条件かつ高い原子効率でC-H官能基化を実現する優れた手法として注目されている。これまでに数多くのHAT触媒が開発されてきたが、強固なC-H結合をもつ脂肪族化合物に適用可能な触媒は少なく、位置選択性などの面で課題を残していた。我々は、安価な1,4-ジアザビシクロ[2.2.2]オクタン (DABCO) を原料とする調製・修飾が容易な新規HAT触媒を創製し、これを可視光照射下においてアクリジニウム型可視光酸化還元触媒とともに用いることで、不活性C-H結合の位置選択的アルキル化を達成した。
有機分子触媒化学の研究
研究概要
これまで携わってきた精密ルイス酸や有機金属触媒の合理的な触媒設計研究で得られた知見を活かし、本研究では他に類例を見ないような有機触媒の合理的な触媒設計を行った。すなわち、有機触媒の性能に応じて、「有機塩基触媒」、「有機酸触媒」、「有機酸塩基複合触媒」、「有機ラジカル触媒」という四つの研究項目に分けて、高性能有機触媒の合理的な設計と創製を目指すとともに、これらの過程で見出された高性能有機触媒を駆使して、新たな精密有機合成反応を開拓した。
また、研究の進め方として、「ゼロ(無)から1(有)を生み出す基礎研究」と「1から1万、10 万を生み出す展開研究」の双方を目指すことにより、高性能有機触媒プロジェクトを強力に推し進めた。
有機塩基触媒
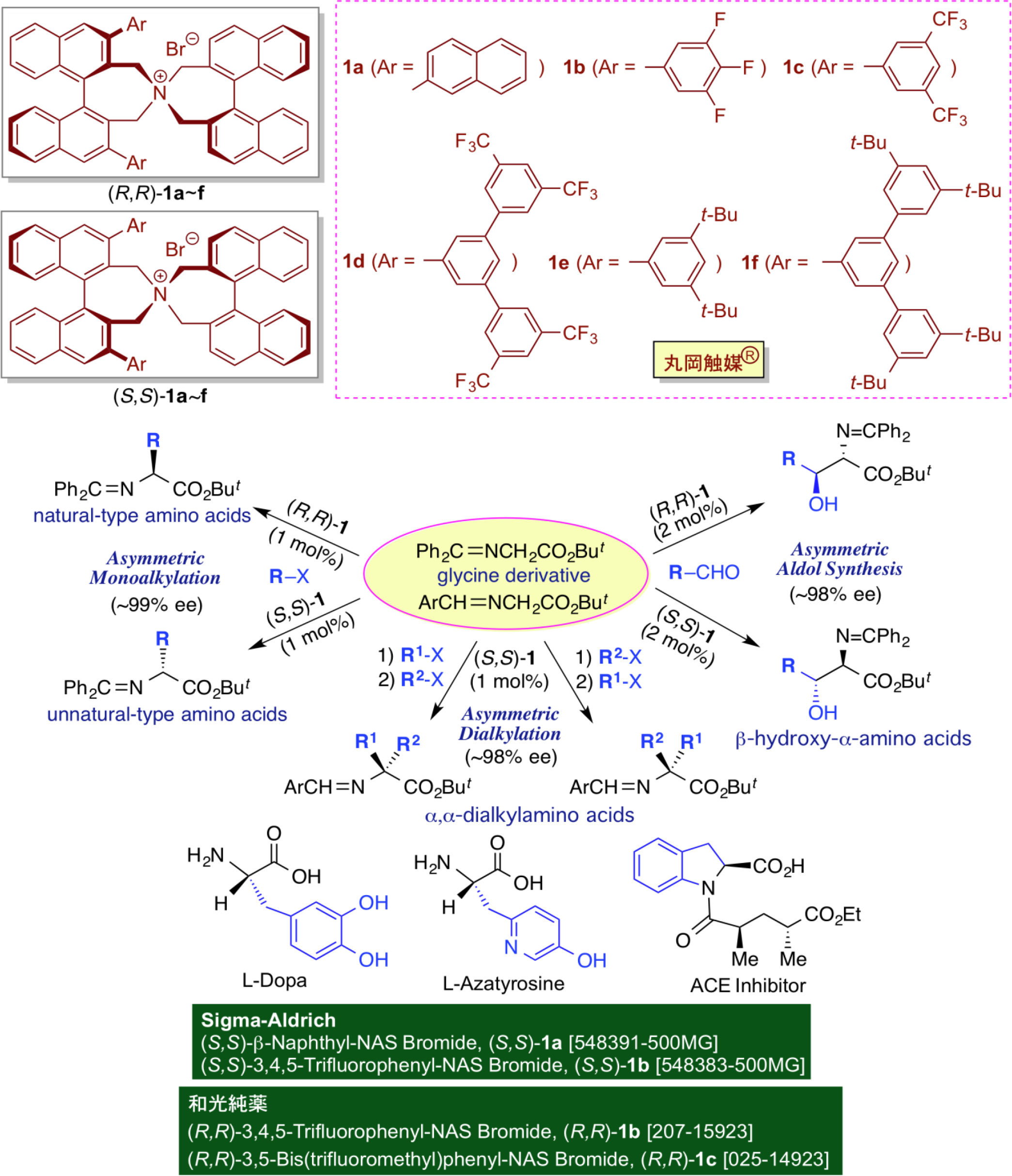
有機塩基触媒として、キラル相間移動触媒に着目し、以下の研究を展開している。 相間移動触媒としてのテトラアルキルアンモニウム塩(R4N+X-)は、そのイオン構造のため通常水溶性であるが、そのアルキル基が長鎖になると脂溶性が高まり有機溶媒にも可溶となる。この特性を相間移動触媒として利用することにより、各種の反応を常温でしかも水 の存在下で行うことが可能となり、同時に反応速度の大幅な増大が期待できるようになる。さらに実験操作が非常に簡便となるなど、様々な合成化学的な利点がある。このような観点から相間移動反応は、水溶液中、常温、常圧、開放系で行なえるため、極めて工業化しやすい反応システムである。しかしながら、不斉合成のための効率良いキラル相間移動触媒の調製は容易ではなかった。これまでの唯一の成功例はシンコナアルカロイド由来のキラル相間移動触媒であったが、これらは常に触媒設計やハロゲン系溶媒の使用といった制約を受けるため、適用可能な有機合成反応に限りがあった。キラル相間移動触媒反応系を多様な不斉合成反応へと適用すべく、新たなデザイン型キラル相間移動触媒の開発が望まれる中、我々は入手容易な光学活性ビナフトールから調製した第四級アンモニウム塩型キラル相間移動触媒(R,R)-1及び(S,S)-1を独自に開発し、「丸岡触媒®」という登録商標を取得するとともに、Sigma-Aldrichや和光純薬工業から試薬として市販されるようになった。その後、このキラル触媒を活用した様々な不斉相間移動反応の開発を行ってきた。中でも、丸岡触媒®を用いたグリシン誘導体の不斉アルキル化反応は、光学活性α-アミノ酸の実用的合成を可能とし、天然型、非天然型アミノ酸も含め、各種のアミノ酸誘導体やそれらの関連体(アミノアルデヒド、アミノケトンやアミノアルコールなど)の不斉合成が可能となった。例えば、生理活性アミノ酸としてパーキンソン病の治療薬、L-ドーパ、抗生物質、L-アザチロシン、 ACE阻害剤などが実用的レベルで容易に合成できる。
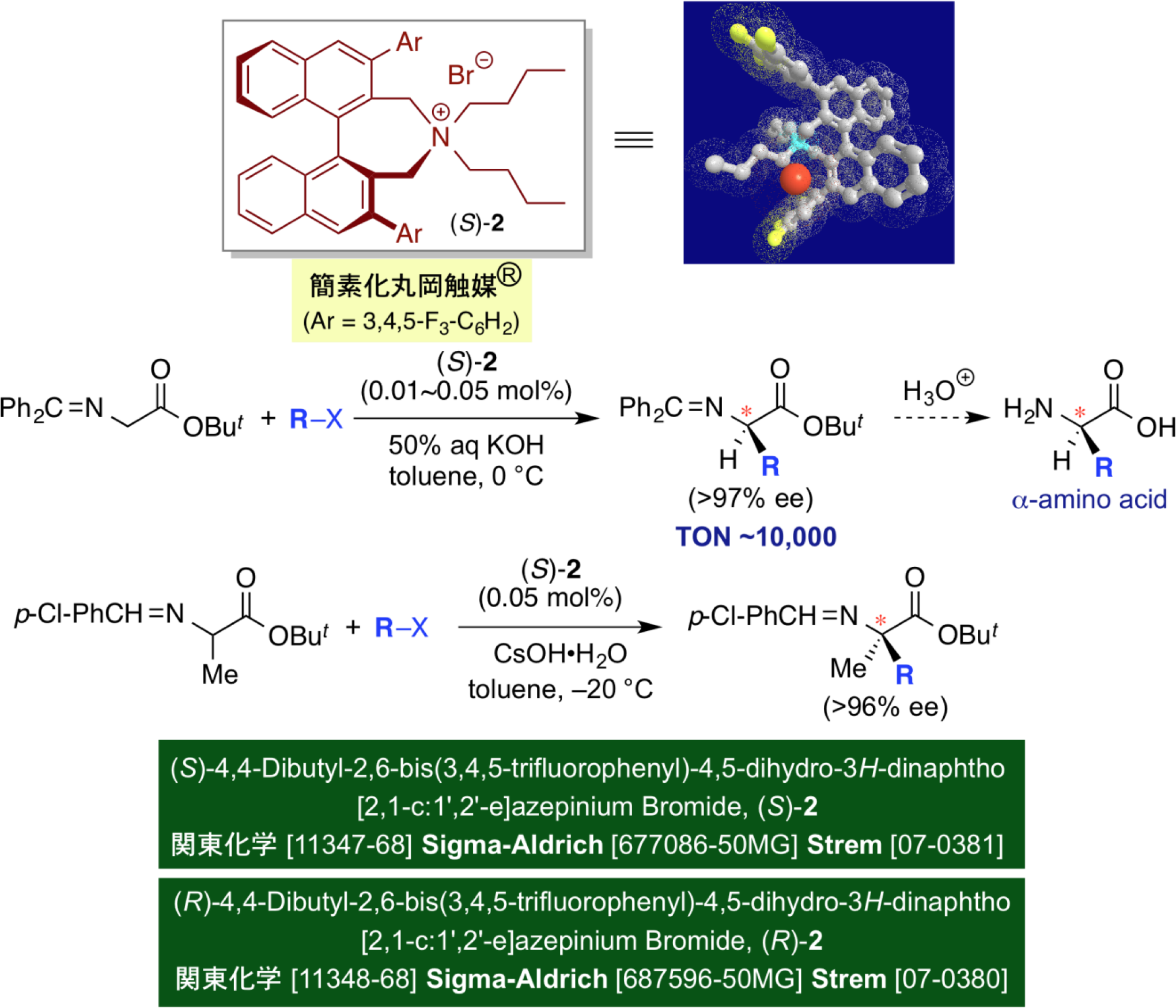
我々は、さらにこのキラル触媒を活用する人工アミノ酸合成の実用化、工業化を目指し、二種類のビナフチル基から成るスピロ型キラル相間移動触媒だけでなく、片側のビナフチル基を単純なアルキル鎖に置換した触媒(S)-2においても、グリシン誘導体の不斉アルキル化がほぼ完全な選択性で進行することが見出された。この際、有機分子触媒としては極めて少量といえる、わずか0.01モル%の触媒量でも反応は円滑に進行し、高い不斉収率を示した。また、この手法をα-アルキルアミノ酸誘導体に適用することにより、光学活性α,α-ジアルキルアミノ酸の触媒的不斉合成法が確立できた。このキラル触媒に対し、「簡素化丸岡触媒®」という登録商標を取得するとともに、Sigma-Aldrich、Strem及び関東化学から試薬として市販されるようになった。この高活性・高性能のキラル触媒を利用することで、長瀬産業やキシダ化学による医薬中間体としての各種人工アミノ酸合成の工業化に成功した。

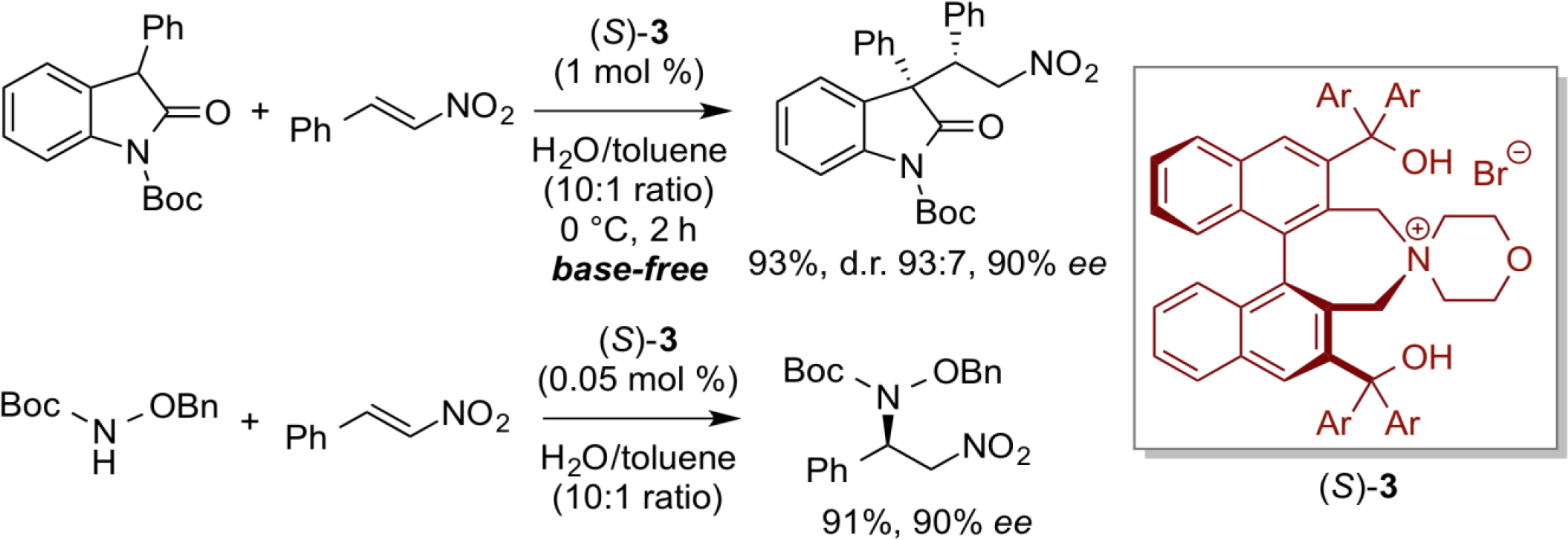
前述の反応のように、第四級アンモニウム塩を相間移動触媒として用いた反応系では、水酸化カリウムのような塩基の添加が反応促進のために必須であると考えられてきた。しかし、これまでの常識を覆す、外部塩基の添加を一切必要としない中性条件下で進行するキラ ル相間移動触媒反応系を見つけることができた。本反応系は、二官能性相間移動触媒(S)-3の存在下、水溶媒中に固体の基質および触媒を溶解するための極少量の有機溶媒を添加するのみで反応が実施でき、環境調和型の実用的反応系といえよう。
有機酸触媒
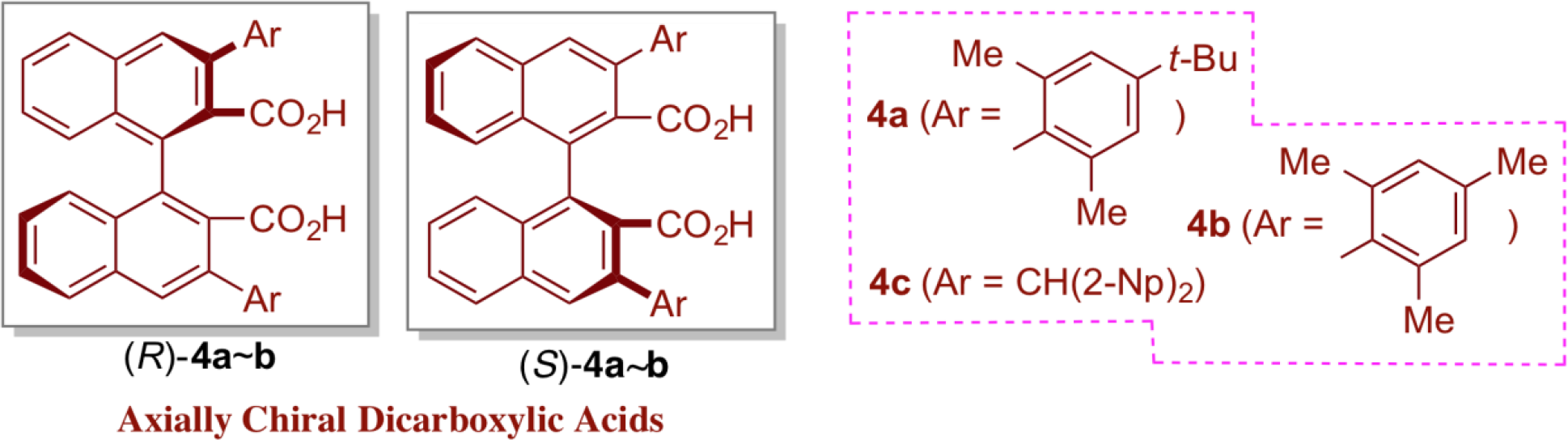
有機酸触媒を利用した触媒的不斉合成においては、その水素結合供与体の酸性度が反応実現の鍵であるため、光学活性アルコール、チオ尿素、リン酸などのようにそれぞれ反応系に応じて使い分ける必然性が生じる。しかしながら興味深いことに、もっとも一般的な弱酸であるカルボン酸を有機酸触媒として用いた報告はほとんどなされていない。このことは有機酸塩基触媒の中で最も重要かつ高い実用性を有するプロリンが、その酸触媒部位としてカルボン酸を利用している事実と極めて対照的である。当研究室では有機酸触媒研究におけるこの空白を、(1)カルボン酸周りに有効な不斉場を構築することの難しさ、(2)カルボン酸の酸触媒としての活性の低さ、の二点が主要な原因であると捉え、これら問題点を克服する新たな触媒分子デザインを行った。その結果、水素結合を介した分子内相互作用が可能な距離に二つのカルボン酸を配置する軸不斉ジカルボン酸触媒(R)-4が、他の有機酸触媒とは明らかに異なる独自の触媒活性を有することを見出した。
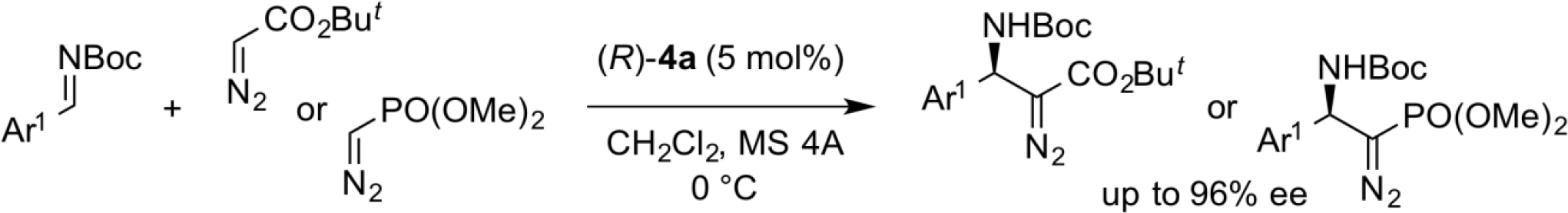
ジアゾ化合物のマンニッヒ型付加反応
軸不斉ジカルボン酸触媒によって活性化されたN-Bocイミンに対して、ジアゾ酢酸エステルおよびジアゾリン酸エステルが高エナンチオ選択的に付加することを見出した。得られた化合物は、薬理活性中間体として有用なβ-アミノ酸やアミノリン酸エステルへと容易に変換できる。
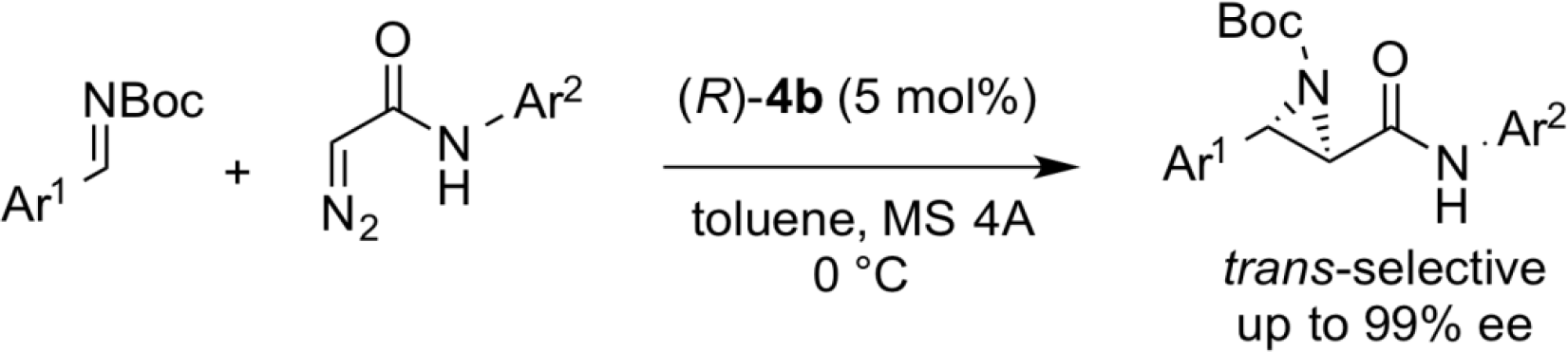
トランス選択的アジリジン化反応
上記マンニッヒ型反応において、ジアゾ酢酸エステルからジアゾアセトアミドへと基質を変更することにより、アジリジン化反応が選択的に進行することを明らかにし、光学活性ルイス酸触媒を用いた類似のアジリジン化反応がシス選択的であるのに対し、本反応系ではトランス体を優先して生じることが見出された。
イミノ-アザエナミン反応
N,N-ジアルキルヒドラジンとアルデヒドの脱水縮合によって得られるアザエナミンと総称される化合物のN-Bocイミンへの触媒的不斉付加反応を開発した。既存の触媒系では到達できない優れた立体選択性・基質一般性が特徴である。
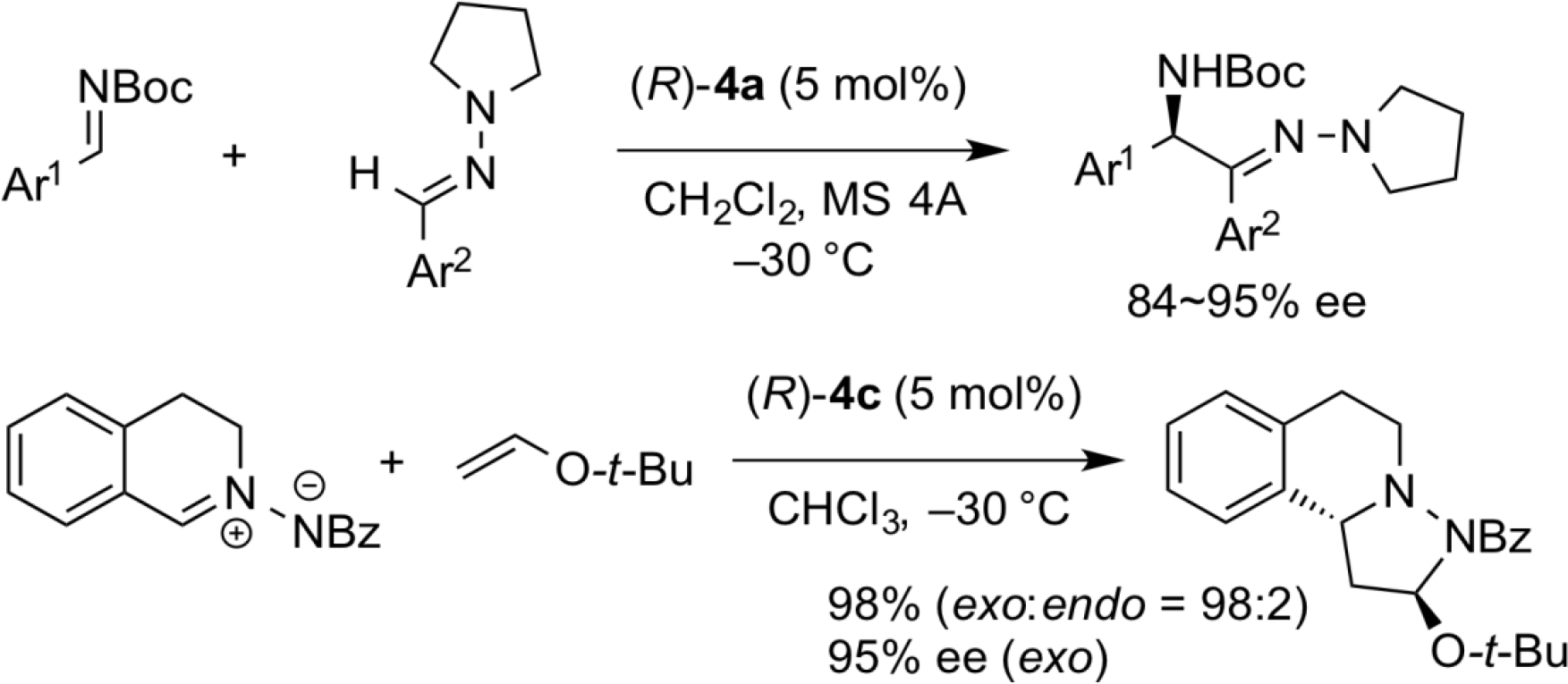
ホウ素を含む有機酸触媒の化学
キラルなジオールと2-ボロノ安息香酸とから調製したキラル酸触媒(S,S)-7は、ユニークな反応性を示し、N-Boc-イミンとジアゾアセトアミドのトランス選択的不斉アジリジン化反応が選択的に進行することを明らかにした。
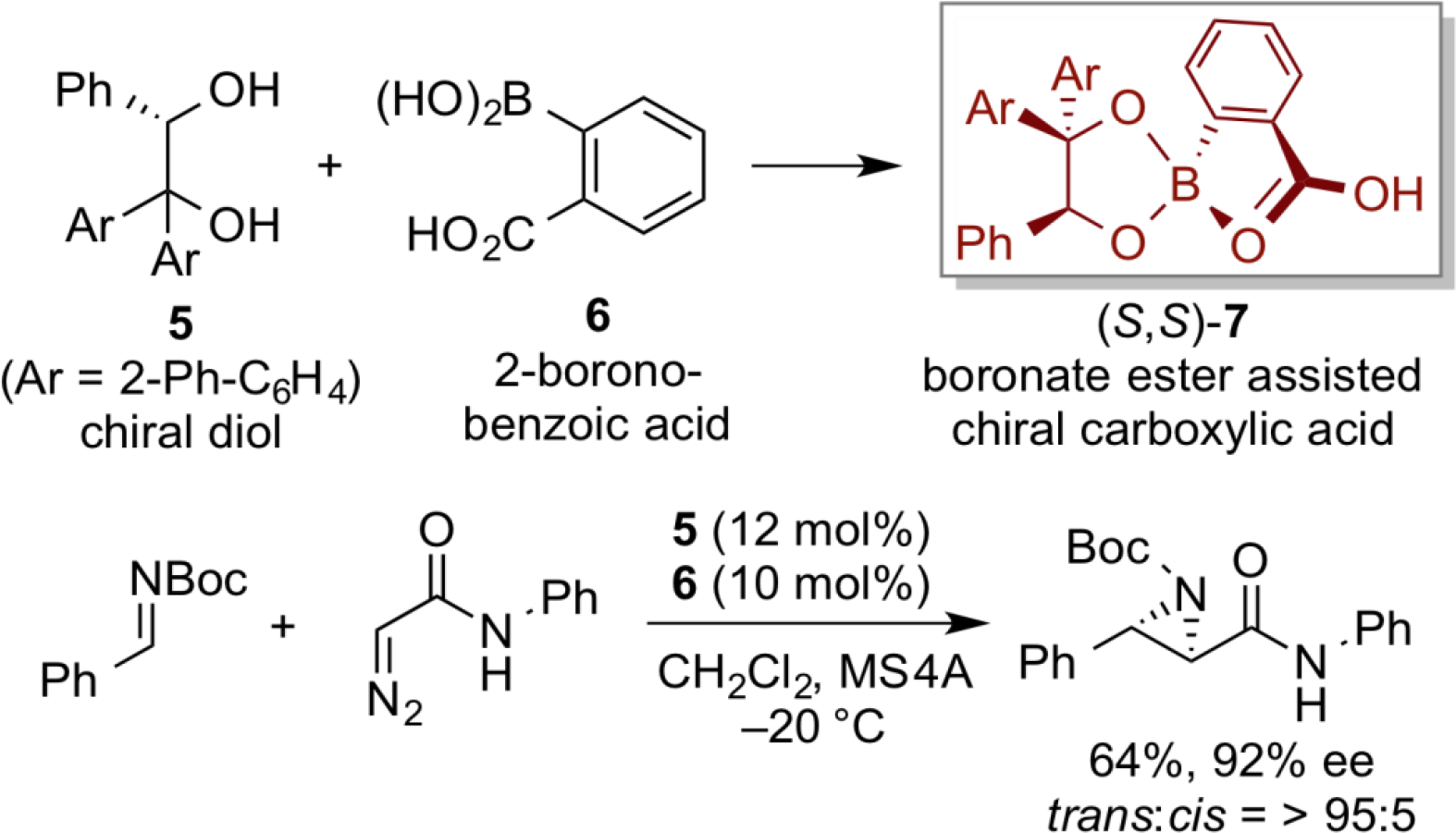
光学活性ビナフトールを有するキラルボロン酸を中心としたキラル酸触媒(S)-8を調製し、ヒドロキサム酸のキノンイミンケタールへの不斉アザ-共役付加反応に適用したところ、高エナンチオ選択的に反応が進行することを見いだした。
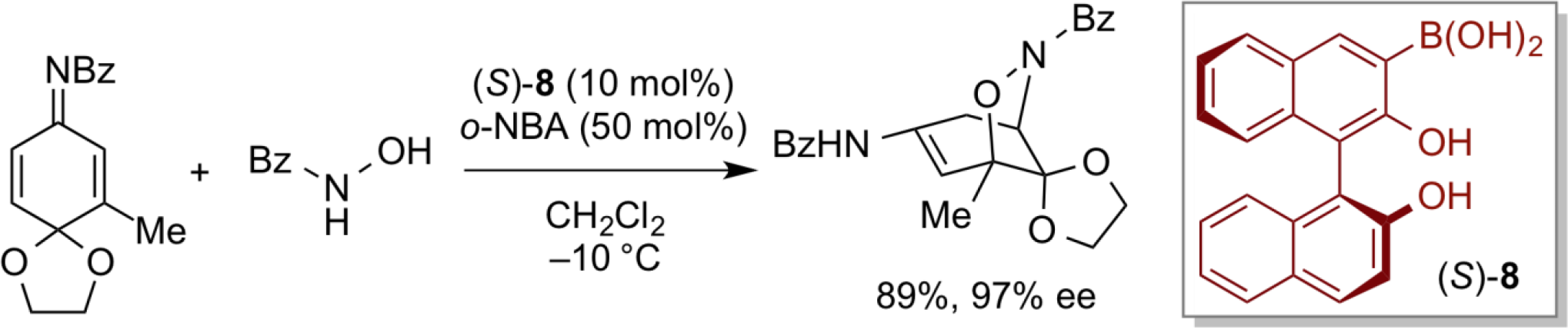
また、近年、全く新しい展開として、π酸である求電子的セレン種に高効率的キラル有機酸触媒としての性能を付与することに成功している。この求電子的セレン型キラル酸触媒9に関する知見を深め、β,γ-不飽和カルボン酸の不斉ラクトン化反応等、幾つかの精密不斉合成反応に適用することができた。
有機酸塩基触媒
近年精力的に研究されている有機分子触媒は、プロリンをはじめとするアミノ酸やシンコナアルカロイドに代表されるように天然物由来のものが多く、原料の入手や触媒調製の簡便さといった利点を持ち、現在までにも様々な不斉反応にお いてその有効性が示されている。しかし一方で、触媒の構造が原料となる天然物の構造に強く依存していることから、目的の反応に応じた自由な触媒設計には限界がある。そこで本研究室では、入手及び修飾の容易な人工の不斉素子であるビナフチル基を触媒の基本骨格とすることで、天然由来の有機分子触媒では困難であった広範な官能基の導入による軸不斉有機分子触媒の精密設計を行い、従来の触媒では実現不可能な反応性や選択性の獲得を目指している。
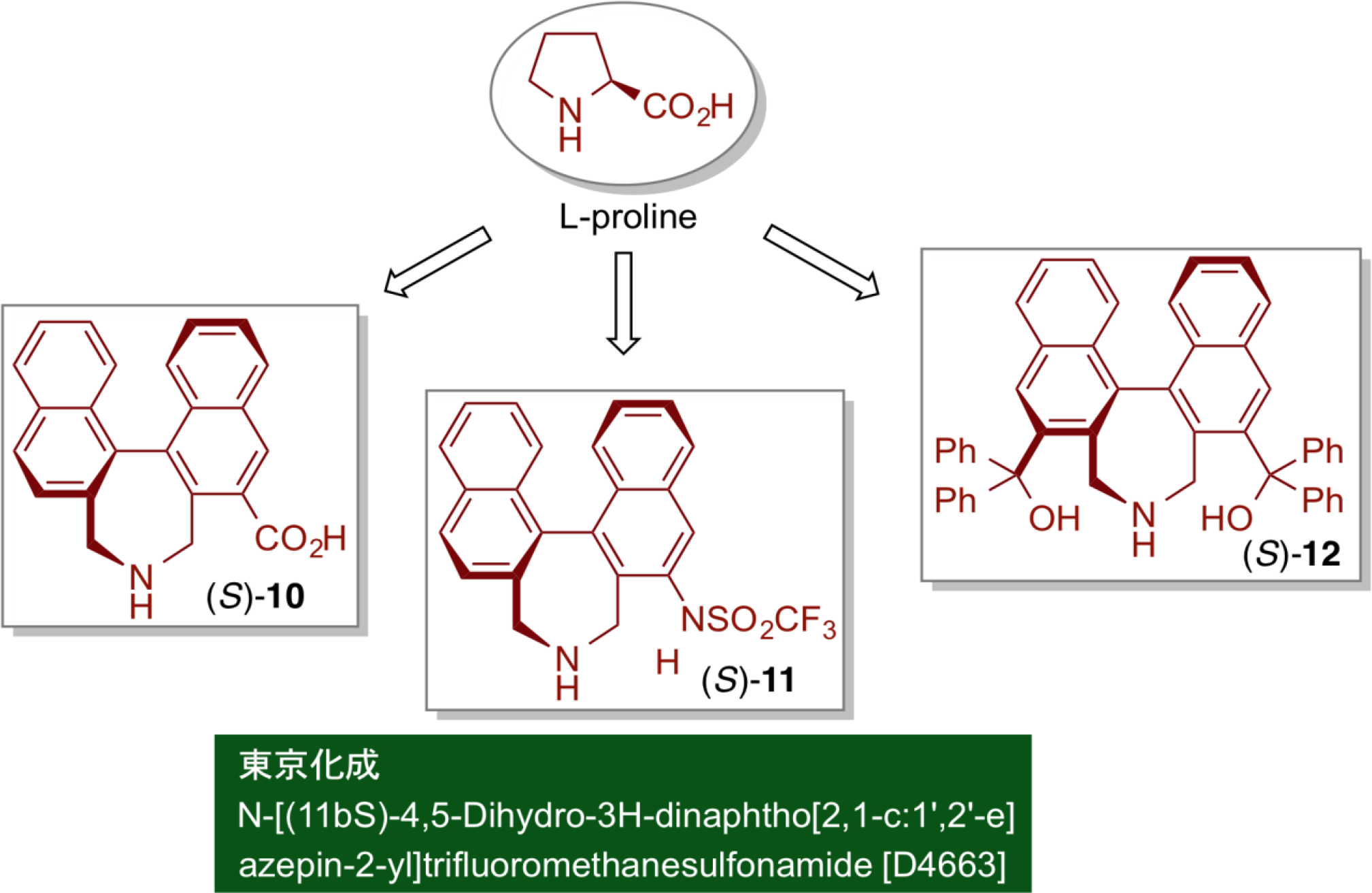
直截的不斉アルドール反応
軸不斉を有したビナフチル骨格に二級アミン部位とカルボキシル基を導入することで、人工アミノ酸 (S)-10を合成し、直截的不斉アルドール反応に触媒として用いたところ、天然のアミノ酸であるプロリンでは実現困難な触媒量の低減化と高いエナンチオ選択性が認められた。さらに、光学活性ビフェニル型のアミノカルボン酸を創製することにより、大幅な触媒量の低減化と高エナンチオ選択性の発現に成功した。
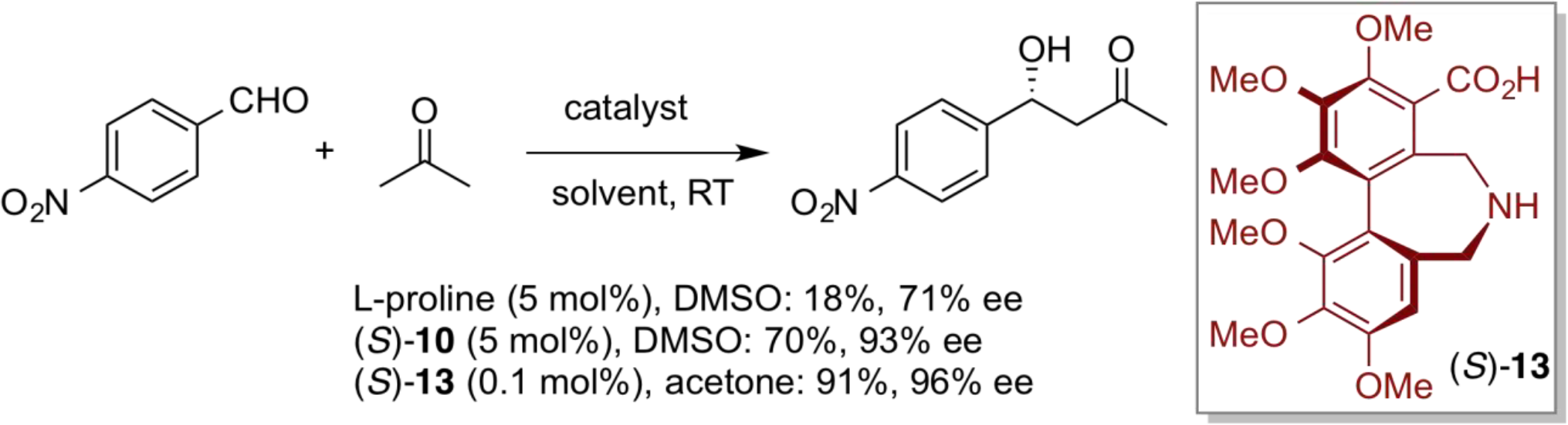
アンチ-選択的不斉マンニッヒ反応
マンニッヒ反応はβ-アミノカルボニル化合物を与える重要な炭素–炭素結合形成反応であり、近年は有機触媒による直截的不斉マンニッヒ型反応が数多く報告されている。触媒としてプロリンを用いた場合、触媒とアルデヒド、またはケトンから系中で生成するs-トランス配座のエナミン中間体が、触媒の酸性プロトンによって活性化されたイミンに求核付加し、シン体の生成物が高エナンチオ選択的に得られる。一方、アミノスルホンアミド触媒(S)-11を用いた反応では、s-シス配座のエナミン中間体を経て、アンチ体の生成物が高エナンチオ選択的に得られる。本反応は、反応速度が速く、エナミン中間体を経由する有機触媒としては極めて少ない触媒量(~0.2 mol%)でも反応が円滑に進行する。また、触媒が安定なため回収再利用が可能である。本触媒は、その後、東京化成(株)から試薬化された。
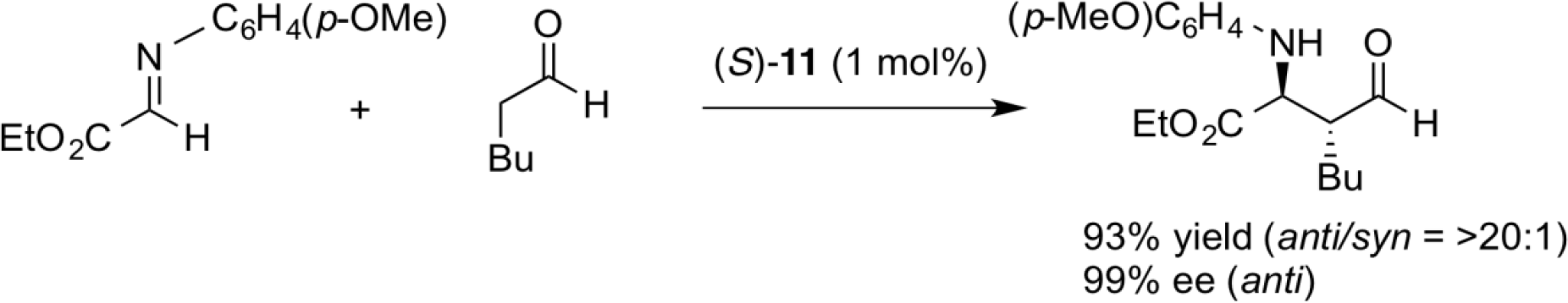
直截的不斉マンニッヒ反応
反応性の高いアセトアルデヒドの直截的不斉マンニッヒ反応では、アルドール反応などの副反応が収率低下の原因となるが、プロリンと比較して穏やかな求核性を有するキラル酸塩基複合触媒 (S)-11を用いることで、触媒量の低減下と収率の向上に成功した。
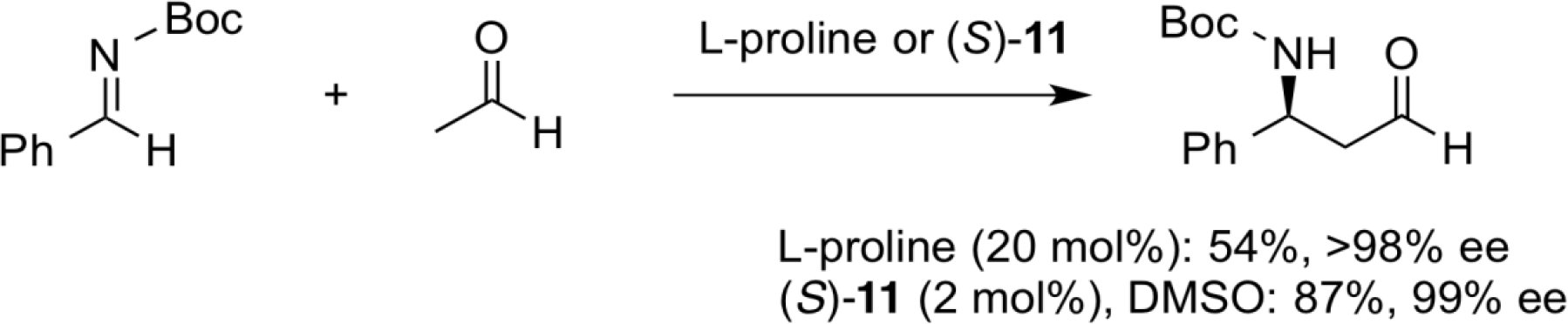
直截的不斉ヒドロキシアミノ化反応
プロリンを触媒としたアルデヒドのニトロソ化合物への付加反応では、ニトロソ化合物のN=O部位の酸素側で結合形成したアミノヒドロキシル化合物が得られることが知られている。一方、ビナフチル骨格にかさ高い三級アルコール部位を導入したキラル酸塩基複合触媒、(S)-12を用いると、ニトロソ化合物への付加の位置選択性が逆転し、直截的不斉ヒドロキシアミノ化反応が高エナンチオ選択的に進行する。
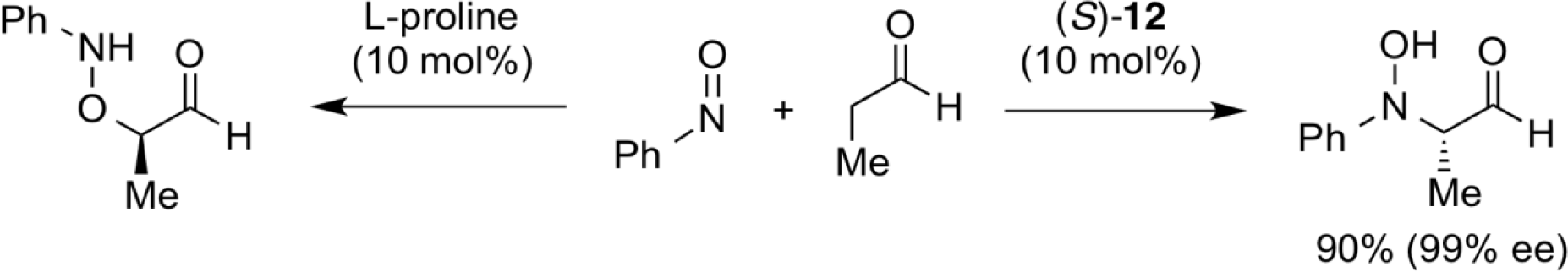
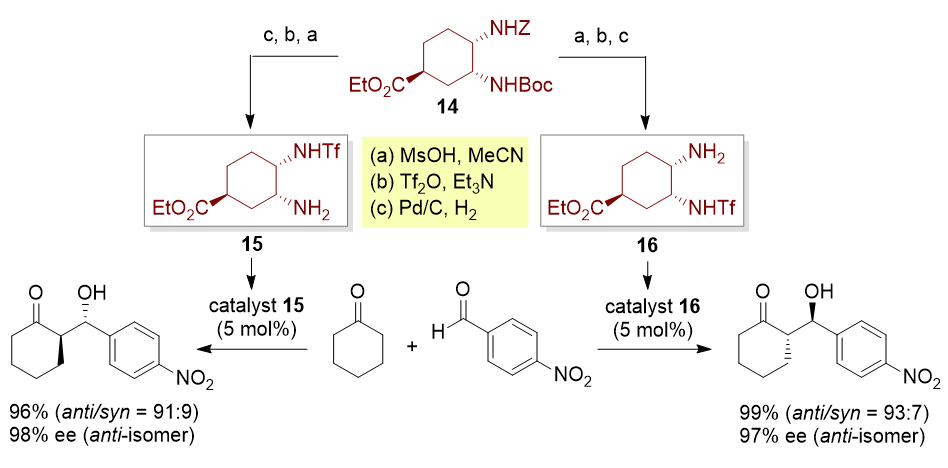
触媒設計の新たなコンセプトを基に、六員環シス-ジアミン型二官能性有機触媒15及び16を開発した。六員環シス-ジアミン型二官能性有機触媒の特徴は、従来の有機触媒とは違い、共通のキラル原料14よりふたつの異なるキラル二官能性有機触媒15及び16が創製できるという点にある。これらふたつの二官能性有機触媒はそれぞれ不斉アルドール反応に用いると、アルドール生成物としての両方の光学異性体が高い立体選択性で得られる。このように従来の有機触媒をそれぞれの光学異性体を合成する場合、両方のキラル触媒を創製する必要があったが、この手法により光学異性体合成が格段に簡便になった。これはキラル有用化合物の効率的大量合成プロセスという観点からは非常に実用的である。
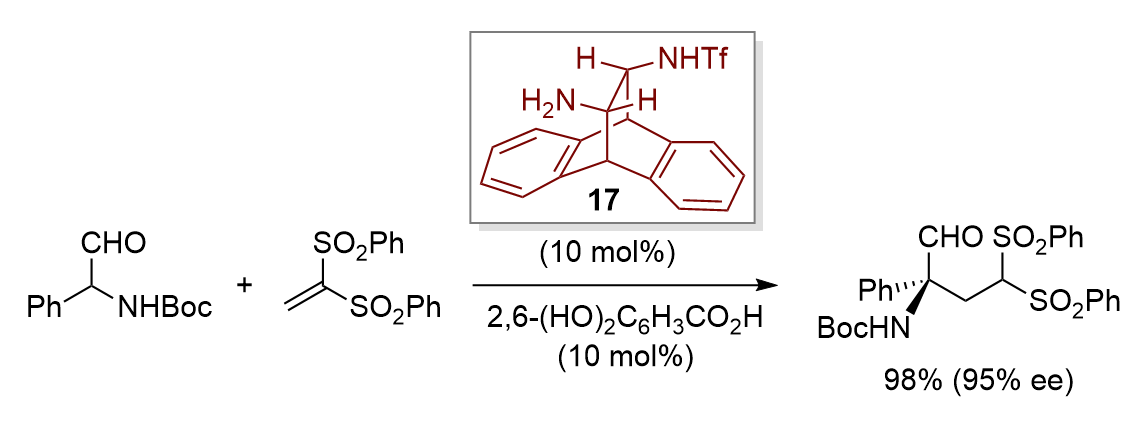
また、アントラセンから誘導したトランス-ジアミン型二官能性有機触媒17を開発し、これを用いたα-アミノアルデヒド誘導体の高エナンチオ選択的共役付加反応の開発にも成功している。
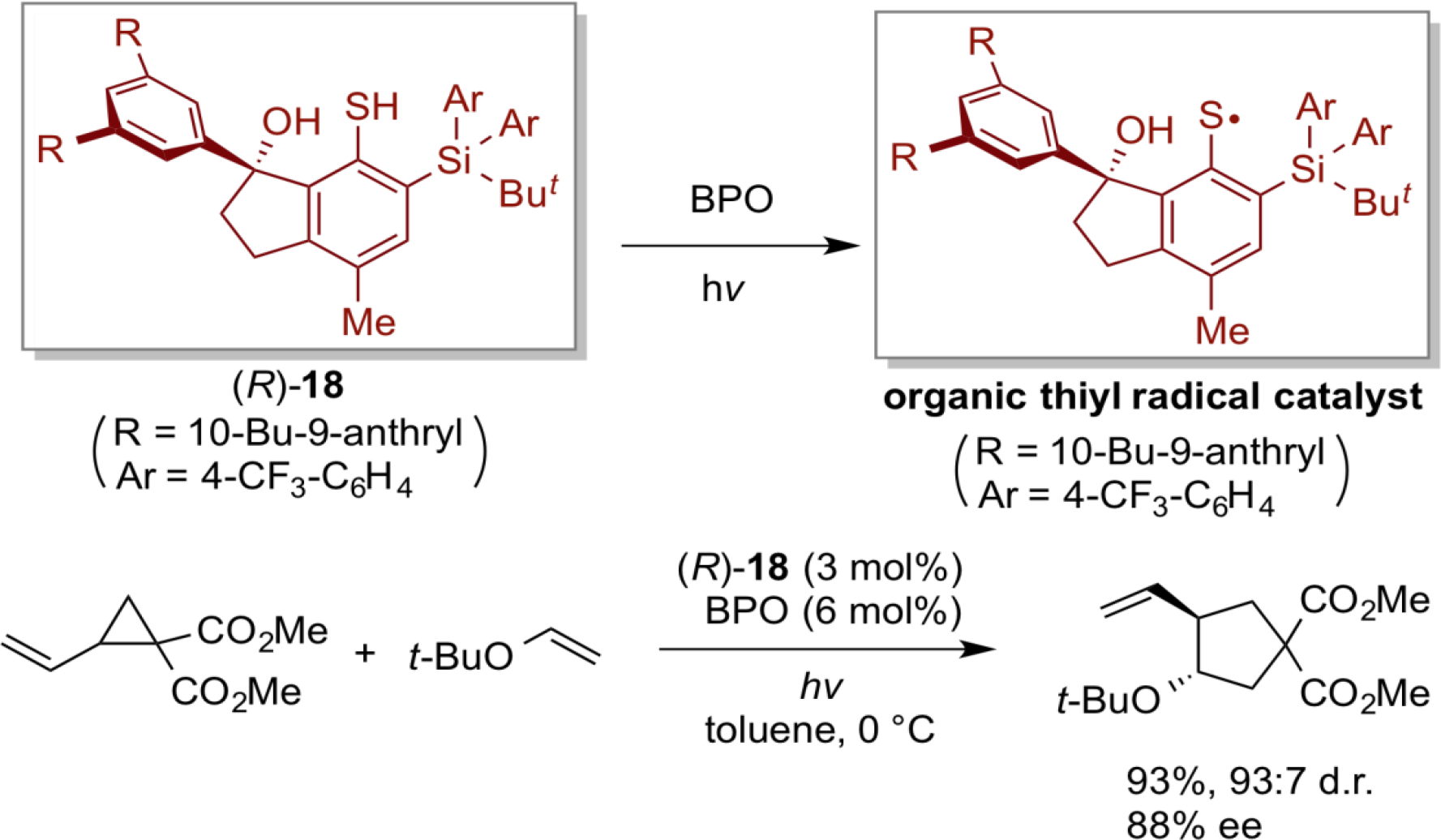
有機ラジカル触媒
高い反応化学種であるラジカルを利用するラジカル反応は、イオン反応では実現し難い変換を可能にする魅力的な反応系である。しかしながら、ラジカル反応を促進、制御する有機ラジカル触媒の研究は、他の有機分子触媒と比較すると著しく遅れている。 我々は、有機ラジカル触媒の開発にあたり、ジスルフィドやチオールから容易に発生させることができる有機硫黄ラジカルに着目し、硫黄ラジカルが触媒活性種として働く、新たな有機ラジカル触媒の開発に取り組んだ。その結果、ビニルシクロプロパンとオレフィン間の不斉ラジカル環化反応において、独自にデザインしたキラルなインダノール骨格を有するチオール(R)-18から発生させた有機硫黄ラジカルが、高い収率及び立体選択性で、環化生成物を与えることを見出した。本反応系は、触媒量の(R)-18及び過酸化ベンゾイル(BPO)存在下、光の照射のみで円滑に環化反応が進行し、様々な多置換シクロペンタンを合成することができた。
この研究で見出されたキラルなインダノール骨格は、他の有機分子触媒を設計する上での重要なプリビレッジド構造 (Privileged structure)であることが判り、その後、同様の鍵骨格を有する有機セレン触媒9や有機ヨウ素触媒19の設計が可能になり、それぞれβ,γ-不飽和カルボン酸の不斉ラクトン化反応やフェノールの不斉脱芳香族化反応に適用することができた。
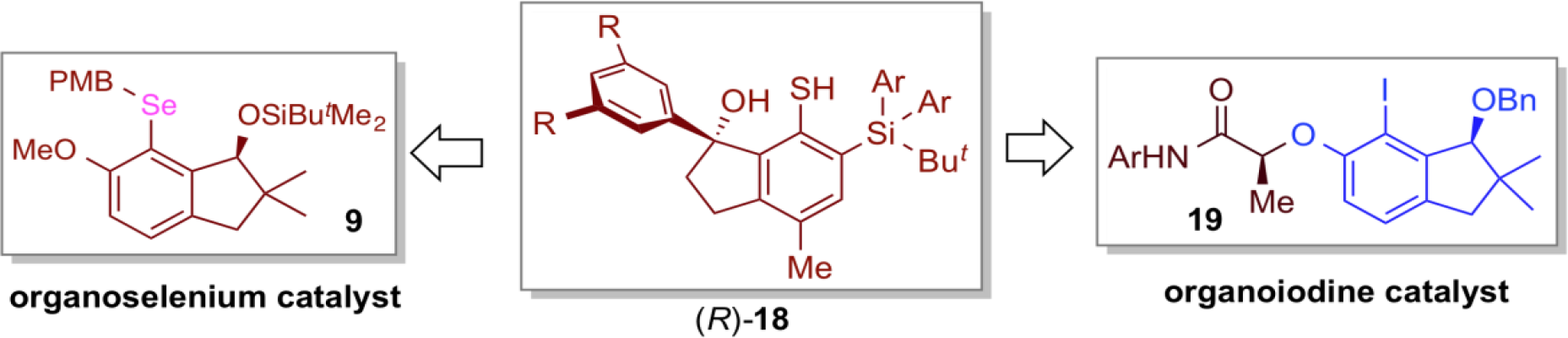
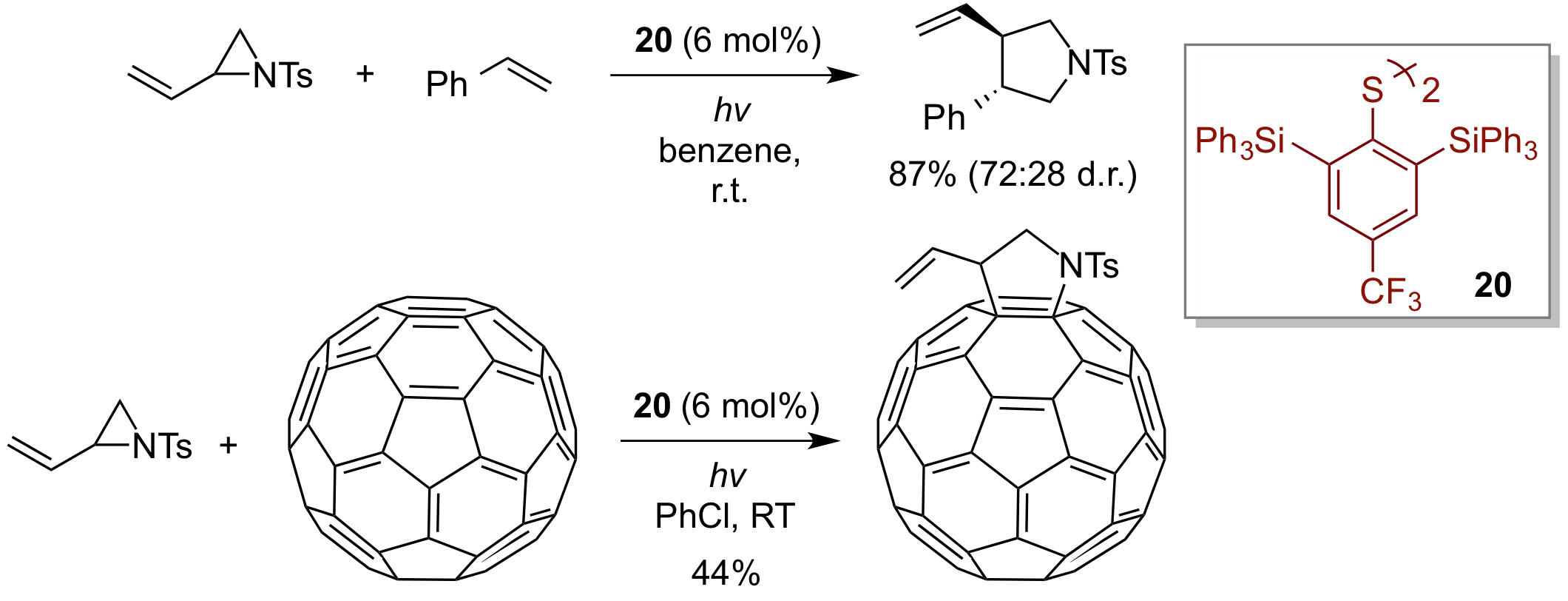
また、立体的に嵩高いジスルフィド20を有機ラジカル触媒として用いることにより、含窒素三員環化合物であるビニルアジリジンとオレフィン間でのラジカル環化反応の開発にも成功した。この手法は、フラーレンの官能基化に有用であることが判った。
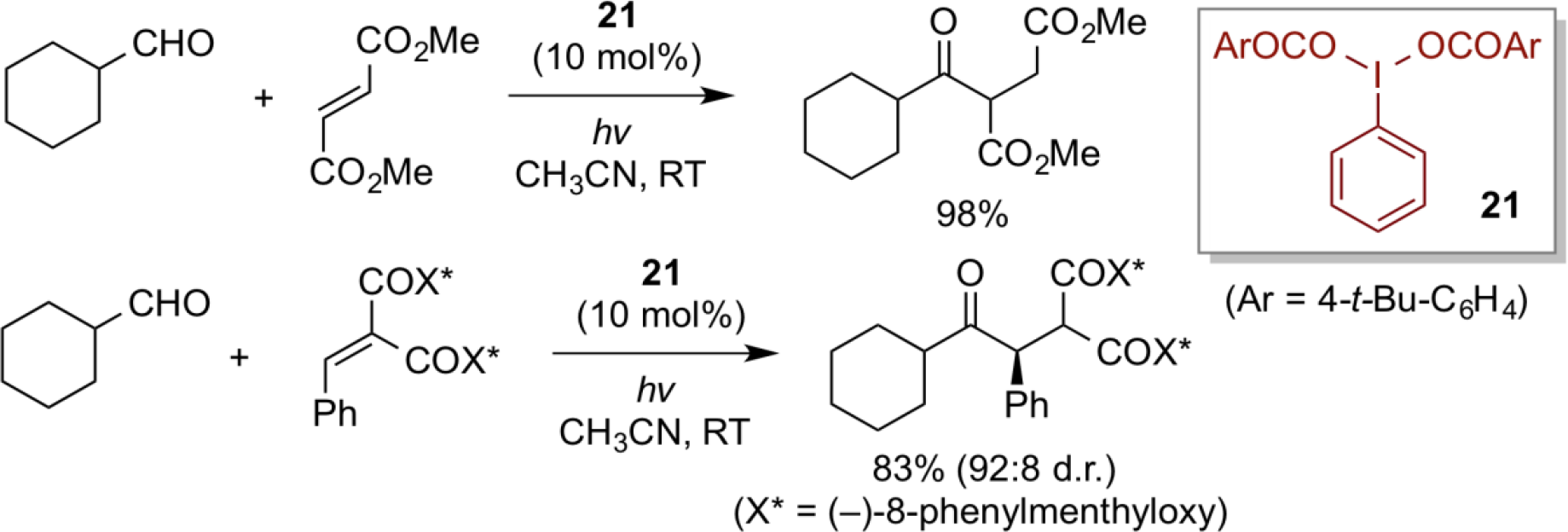
一方、我々は、超原子価ヨウ素化合物の光分解を利用した、脂肪族アルデヒドからの直接的なアシルラジカルの発生と、続く電子不足オレフィンに対するラジカル的共役付加反応の開発に成功した。 本反応は触媒量の超原子価ヨウ素剤21の存在下、可視光を照射することで進行し、 様々なケトン体が良好な収率で得られる。アルデヒドから直接アシルラジカルを発生させる手法は、一般に高い反応温度や遷移金属触媒を必要とするものが多く、かさ高い脂肪族アルデヒドから発生するアシルラジカルにおいては、容易に一酸化炭素を放出してアルキルラジカルを与えることが知られている。 そのため、脂肪族アルデヒド由来のアシルラジカルを効率的に発生させる手法は数が限られていた。本反応系は、温和な条件で進行するため、枝分かれしたアルデヒド基質を用いても脱一酸化炭素といった副反応が見られないため、優れたアシルラジカルの発生法といえよう。この反応は、光学活性不飽和マロン酸エステルに適用することにより、アシルラジカルのジアステレオ選択的付加反応が実現できた。
 ページトップ
ページトップ
