骨転移巣へのタンパク質ターゲティングシステムの
開発による骨転移抑制
薬品動態制御学分野 兵頭 健治
研 究 指 導 主 任 : 薬品動態制御学分野 教授 橋田 充
研究指導協力者 : 病態機能解析学分野 教授 佐治 英郎
研究内容
背景と目的
抗癌治療の進歩により原発主要は制御がほぼ可能となった。一方、遠隔臓器への転移の制御はいまだに困難であり、癌患者が死亡する最大の要因である。したがって、癌研究・治療の今後の目標は遠隔臓器への転移の制御となることは明白である。癌の転移標的臓器として骨は肺・肝臓に匹敵する転移好発臓器である。しかし、骨に転移した癌に対して通常の抗癌療法はその組織構造と血流量の低さから功を奏しにくい。薬理効果を発揮するためには薬物を骨末端の法的部位に効率よく送達させる必要があるが、その実現は困難であり、薬理効果を確実にするためには薬物の血中濃度を高くしなければならず、結果として投与量の増大や頻回投与を余儀なくされるなどの問題を抱えている。これらの要因により他の正常組織や全身に副作用を引き起こすことが投薬上の大きな障害となっている。こうした背景の中、骨を標的としたドラッグデリバリーシステム(DDS)は骨疾患に対する薬物療法における問題を解決する方法として期待されており、近年盛んに研究が進められている。申請者はこれまでに肺、肝臓、腹膜への転移を血中滞留型PEG-caralase、肝実質細胞指向型Galcatalase、腹腔内滞留型ED-catalaseにより効率的に抑制できることを明らかにした。これらの結果は癌転移過程における活性酸素も重要性を示すものであるとともに、catalase誘導体が転移に対して有効であることを示すものであると考えられている。そこで、本研究ではcatalaseをはじめとする種々タンパク質医薬品や薬物の骨特異的デリバリー技術の確立およびそれを用いた骨転移抑制法の開発を目指す。
本研究では、癌患者の生命を脅かす最大の要因である骨転移、その中でも特に治療が困難で、耐え難い骨痛・病的骨折・運動制限・高カルシウム血症などを合併し患者のQOLを著しく低下させる癌の骨転移抑制法の開発を目的とする。そのアプローチとして、生理活性タンパク質(活性酸素消去酵素)を骨特異的にデリバリーする技術の確立を目指す。癌の転移抑制を目的として癌細胞特異的な抗体を標的指向素子とし癌細胞へ直接ターゲティングするアプローチも行われているが、癌細胞の多様性および遺伝子的不安定さから普遍的なターゲティング技術とは成り得ない。そこで本研究では、癌細胞の転移標的部位である骨表面に選択的に分布するビスフォスフォネート(BiP)を骨指向素子として選択し、これをcatalaseなどの活性酸素消去酵素をはじめとする生理活性タンパク質と結合させることにより骨表面特異的ターゲティング技術の確立を目指す。BiPは、硬組織に多く存在し、骨のミネラル成分であるリン酸カルシウム(ヒドロキシアパタイト)に親和性が非常に高い、ならびにヒドロキシアパタイトの溶解抑制作用があることが知られている。BiPは生体内に存在し骨代謝を抑制するピロリン酸と類似した構造を有し、ピロリン酸が2つのリン酸基が同一酸素に結合(P-O-P結合)しているのに対し、BiPは炭素に結合(P-C-P結合)したものの総称である。このP-C-P部分がヒドロキシアパタイトに非常に強力な親和力を有し、BiPを体内に投与した場合、投与量の大部分が速やかに全身骨に選択的に分布し、残りは尿中に速やかに排泄される特徴を有する。また近年、BiPによる癌細胞の接着や浸潤、血管新生の抑制による骨転移抑制効果が明らかにされた。したがって、BiPは生理活性タンパク質の指向素子としての機能だけでなく、骨転移抑制能も併せ持つと考えられ、骨転移抑制効果に関して活性酸素消去酵素との相乗効果が期待されてきたにも拘らず、BiPに関する化学構造と薬理活性の相関、定量的構造活性相関(quantitative structure-activity relationship (QSAR))や化学構造と体内動態の相関、定量的構造物性相関(quantitative structure-pharmacokinetic relationship (QSPR))に関する情報はわずかな数にとどまっている。化学修飾によるDDSの設計において一般的に最も困難とされる点は、標的部位への理想的な薬物伝達を可能にするための最適構造を適応する化合物ごとに精密にデザインしなければならないことである。BiP修飾による骨指向型DDSの場合、薬物とBiPとの結合はスペーサーを介して行われ、骨指向性や滞留性などの特性は、適応する薬物、BiPおよびスペーサーのそれぞれの組み合わせによって変化する。これまでタンパク質をBiP修飾した例は非常に少なく、系統的な研究はなされていないのが現状である。BiP修飾タンパク質の化学構造と骨指向性などの体内動態との関係(QSPR)を把握することは、本アプローチを最適化する場合やその他種々の生理活性タンパク質にも適応する際においても非常に有用な情報となり得る。
検討は、BiPのR1基に側鎖として水素・メチル基・水酸基など、R2基にスペーサーを導入しタンパク質と結合させる。血液と骨髄コンパートメントとの物質交換には lining cell により構成される血液―骨髄液関門(blood-bone marrow barrier)が存在し物質輸送が制限されていることから、スペーサーの種類や長さを変化させたものをいくつか作成し、in vitro においてヒドロキシアパタイトとの結合性および酵素活性を確認後、骨転移モデルマウスに投与することでそれらの体内動態を解析する。骨手にモデルマウスは既報に従いマウスメラノーマB16-BL6細胞をC57/BL6マウスの心臓内に投与することで作成する。タンパク質のサイズ・構造およびスペーサーを変化させた場合の体内動態の変化をQSPRの手法を用いて解析することにより、骨へのタンパク質DDS技術の確立を目指す。申請者はすでにレポーター遺伝子を安定に発現する癌細胞の開発に成功しており、これにより癌転移を高感度かつ定量的に評価可能であるばかりでなく、癌細胞増殖の速度論的解析も可能であることから、作成したBiP装飾活性酸素消去酵素の抑制効果を厳密に評価可能と考えられる。また、癌転移は癌細胞自身による血管外基質・基底膜の破壊に始まり、血管内への流入、血流中の移行、血管内皮細胞への接着、血管基底膜の破壊、間質への浸潤、増殖により成立するが、申請者が開発したレポーター遺伝子癌細胞を用いることでこれらの素過程を分離評価可能であることから、BiP修飾活性酸素消去酵素の抑制効果を作用点ごとに解析可能であり、骨転移抑制に最適な投薬スケジュールも設計することが可能となる。
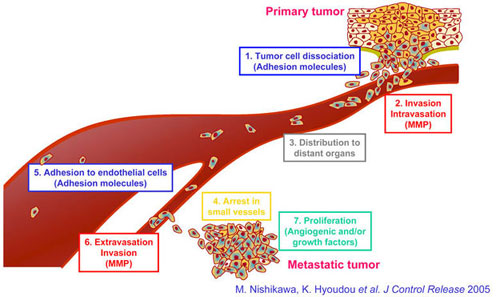
Steps of tumor metastasis progression
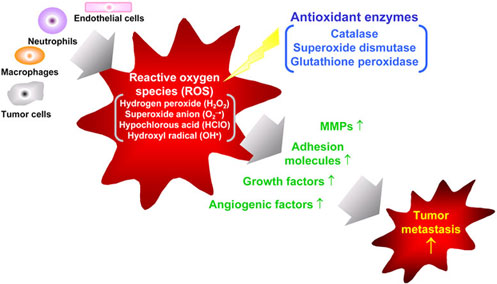
Involvement of reactive oxygen species in tumor metastasis
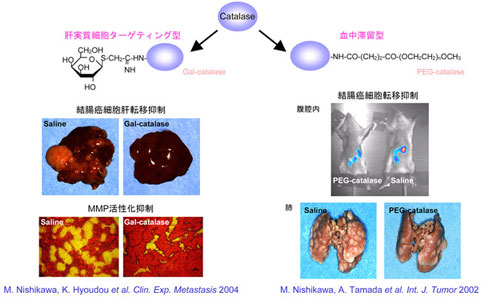
Inhibition of tumor metastasis by targeted delivery of catalase
方法(Materials and Methods)
- レポーター遺伝子発現癌細胞の作成
マウスメラノーマB16-BL6細胞株に対し、luciferase遺伝子をコードしたプラスミドDNAをリポフェクションすることによりluciferase安定発現細胞株B16-BL6/Lucを得た。(Fig.1)
Fig.1 Protocol for the biological labeling of tumor cells by permanent transfection of reporter gene using LipofectAMINE2000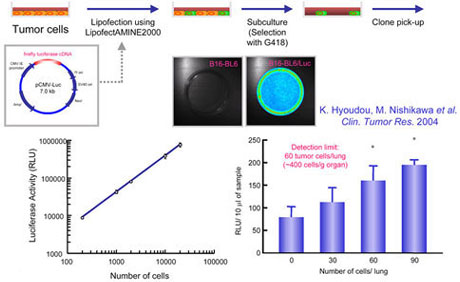
- 実験的肺転移モデルの作成および癌細胞体内動態の定量的解析
C57/BL6雄性マウスの尾静脈内にB16-BL6/Luc細胞を種々の細胞数で投与した。経時的にマウスを屠殺後、肺を摘出した。組織ホモジネート上清中に含まれるluciferase活性を測定し、検量線から癌細胞数に換算することで静脈内投与後の癌細胞体内動態を評価した。(Fig.2)
Fig.2 Time course of number of tumor cells in the lung of mice receiving intravenous injection of B-16-BL6/Luc cells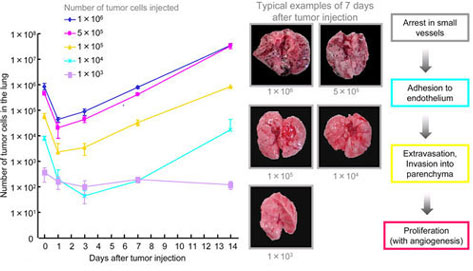
- PEG-catalase の合成
catalaseの血中滞留性の向上を目的として、catalase(分子量 235 kDa)に分子量5000のアミノ基反応型ポリエチレングリコール(PEG)誘導体である 2,4-bis(o-methoxypolyethyene glycol)-6-chloro-s-triazin(生化学工業)を結合することによりPEG-catalase(平均分子量 665 kDa)を合成した。(Fig.3)
Fig.3 Physicochemical properties of catalase derivatives after intravenous injection in mice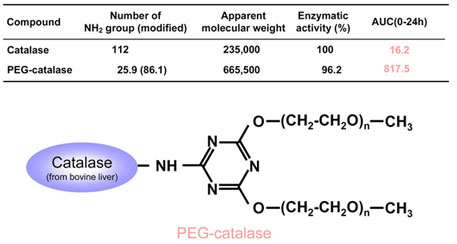
- catalase 誘導体による実験的癌転移抑制効果
C57/BL6雄性マウス尾静脈内にB16-BL6/Luc細胞を投与し、saline,catalase誘導体を種々のタイミングで投与した。一定時間経過後マウスを屠殺後肺を摘出し、癌細胞数を定量することでcatalase誘導体が癌転移のどの過程に対して有効であるか検討した。(Fig.4,5,6)
Fig.4 Effect of catalase derivatives on the early steps of metastasis in mice receiving intravenous injection of B16-BL6/Luc cells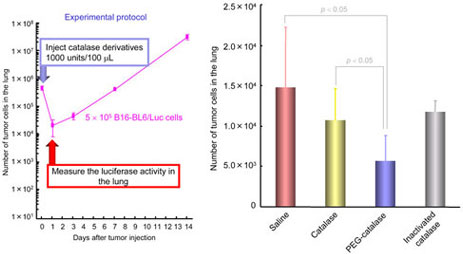
Fig.5 Effect of injection timing of PEG-catalase on the number of cells in mice receving intravenous injection of B16-BL6/Luc cells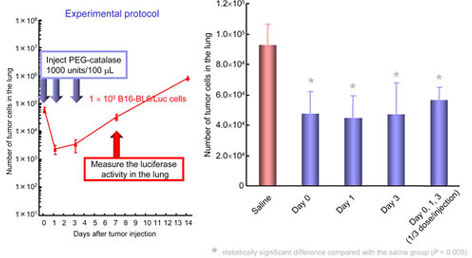
Fig.6 Effect of injection frequency of PEG-catalase on the number of cells in mice receving intravenous injection of B16-BL6/Luc cells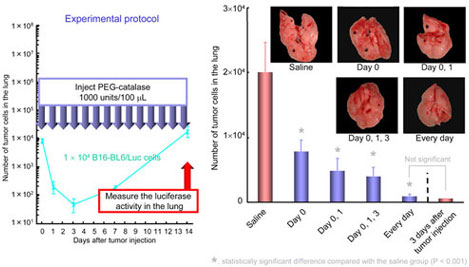
また、catalase誘導体による生存日数延長効果について検討した。(Fig.7)
Fig.7 Survival rate of mice with B16-BL6 pulmonary metastasis treated with PEG-catalase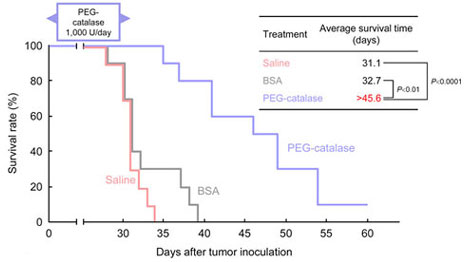
- 骨転移モデルの作成
C57/BL6雄性マウスの左心室内にB16-BL6/Luc細胞(1.0x105cell/100µl)を投与した。癌細胞投与14日後に屠殺後、骨への転移について検討した。(Fig.8)
Fig.8 Bone metastasis induced by injection of B16-BL6 cells into left ventricle
- BiP-catalase の合成
catalaseの骨指向性の向上を目的として、catalase(分子量 235 kDa)にビスフォスフォネート誘導体である3,5-di(ethylamino-2,2-bisphosphono)benzoic acid(アステラス製薬)を結合することによりBiP-catalaseを合成した。(Fig.9)
Fig.9 Structures of pyrophosphate,bisphosphonate and bisphosphonate-conjugated catalase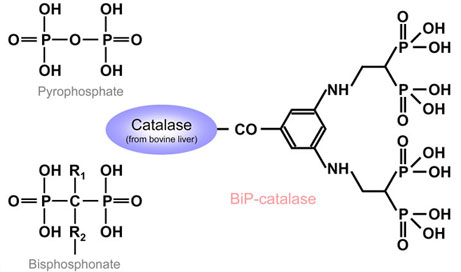
結果(Conclusion)
- Luciferase安定発現癌細胞を用いることで癌細胞動態を高感度かつ定量的に評価可能であることが示された。
- Catalase誘導体により癌転移各過程が有意に抑制可能であり、血中濃度を維持することで延命効果も得られた。
- 癌細胞をマウス左心室内に投与することで骨転移モデルを作成可能であり、またビスフォスフォネート修飾catalaseにより骨転移が抑制できる可能性が示唆された。
|

