
| TOP>融合研究コース 平成17年度 研究報告 | |||||||||||
抗菌性ペプチドの作用標的の制御と
|
|||||||||||
抗菌性ペプチド(antimicrobial peptide)とは[1,2]
[1] Zasloff, M. (2002) Nature., 415, 389-395. [2] Brogden, KA. (2005) Nat Rev Microbiol, 3, 238-250. |
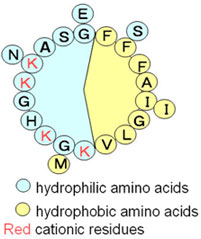 Fig.1 amphiphilic α helical structure of magainin 2 |
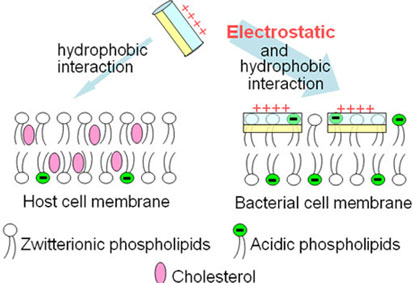
Fig.2 membrane selectivity of antimicrobial peptides
これまでに当研究室はアフリカツメガエルより単離された抗菌性ペプチドmagainin2(GAGKWLHSAKK-FGKAFVGEIMNS)やアジアヒキガエル由来のbuforin2(TRSSRAGLQFPVGRVHRLLRK)の作用機構を、リポソームを用いて明らかにしてきた。Magainin2は脂質膜に脂質を抱き込んだ一時的な超分子複合体ポアを形成し、ポア崩壊時に一部ペプチドが内在化(translocation)する。ポアを通した内容物の流出が抗菌作用の要因であると考えられている。対照的に、buforin2は膜を乱さずに効率よく細胞内に入り、DNAと結合することで抗菌活性を発揮していると考えられている。
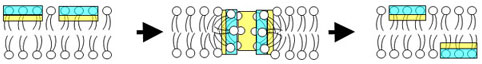
Fig.3 toroidal pore model
[Matsuzaki, K. (1998) Biochim Biophys Acta., 1376, 391-400. ]
目的
本研究では抗菌性ペプチドを元に化学修飾体やアミノ酸置換体を作成し、作用標的を制御して、新規抗菌剤や細胞内分子導入ベクターとして応用することを目的とする。本研究室は主に物理化学的な手法を用いて作用機構を解明してきたが、特に細胞内分子導入ベクターとして応用する際には、ドラッグデリバリーに基づく視点や手法が必要になるため、融合研究として行うことでより興味深い結果が得られると考えられる。
方法
本研究では以下のように、抗菌性ペプチドの化学修飾体やアミノ酸置換体を作成し、作用標的を制御して、新規抗菌剤や細胞内分子導入ベクターとして応用する。
- アミノ酸置換による抗菌性ペプチドの作用標的の制御
- 抗菌性ペプチドを用いた細胞内導入ベクターの開発
これまでに、両親媒性αへリックスのモデルペプチドの疎水面にαへリックスを不安定化するペプトイドを導入すると、標的が膜からDNAに変化すると報告されている。ペプトイドは細胞毒性に関して不明であるという点と、大量合成が難しいので、我々はmagainin2の疎水面にαへリックスを不安定化するプロリン残基を導入し、作用標的が膜かDNAへ変化するかどうかをモデル膜及び細胞を用いて検証する。我々は逆にbuforin2のプロリン残基をアラニン残基に置換することで、標的がDNAから膜に変化することを示した。[Kobayashi, Set al.(2000)Biochemistry,39 ,8648]本研究により、αへリックスの不安定化が抗菌性ペプチドの作用標的の選択性に与える影響が一般的なものであるかどうかが明らかとなる。さらに、プロリン置換体が効率よく膜透過するのであれば、膜を乱さないので細胞毒性を軽減できより良い細胞導入ベクターの開発が可能となる。また、膜作用型とDNA型を混同して用いることで相乗効果が得られるかどうかを検討する。
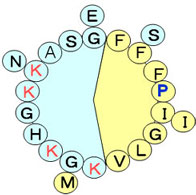
Fig.4 amphiphilic α-helical structure of A9P MG
 |
 |
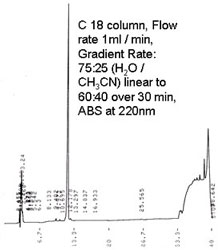
| Fig.5 HPLC chart | Fig.6 ESI MS spectra |
 |
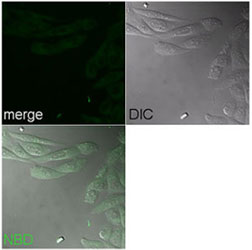 |
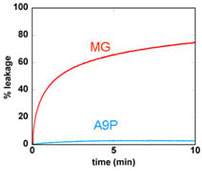
| Fig. 7: Membrane permeabilization activity as estimated by the leakage of the fluorescent dye calcein entrapped within LUVs | Fig. 8: Intracellular distribution of NBD-labeled A9P MG as examined by confocal laser microscopy.NBD-A9P MG were incubated with Chinese hamster ovary cells for 15 min at 37゚C. |
上で検討して得られた知見を元にベクターの配列をデザインし、ペプチド核酸などのカーゴ分子と結合して細胞内へ導入されるかどうか恭焦点レーザー顕微鏡を用いて実験を行う。また、ベクターにオルガネラ局在シグナルを付加することによって、細胞内局在を自在に制御できるかどうかを検討する。
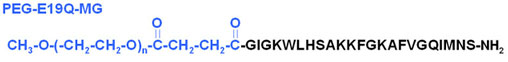
Fig. 9: Amino acid sequence of PEG-E19Q-MG
(M.W. of PEG moiety is 5 kDa on average)
Fig. 10: PNA and DNA
taken from http://complex.upf.es/
成果
- 抗菌性ペプチドの作用標的の制御を研究することは、耐性が生じにくい理想的な抗菌剤の開発へつながる可能性を秘めている。
- 細胞内導入ベクターに関しては、TATなどのアルギニンリッチペプチドが用いられているが、これらのペプチドは主としてエンドサイトーシス経由で細胞内に入るため、細胞質内への導入効率はあまり良くない。一方、抗菌性ペプチドは細胞膜を直接経由して膜透過するのでより直接的で効率よく導入を行うことが出来ると考えられる。
- オルガネラ局在性をコントロールできれば、遺伝子治療などにおいて画期的な成果を上げることが出来ると考えられる。