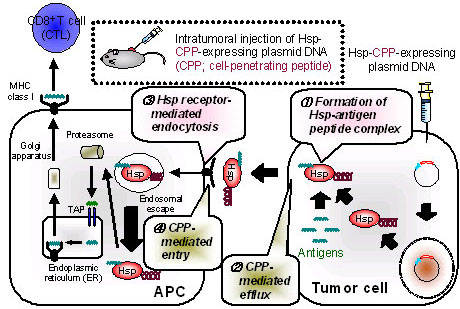
Heat Protein 70(Hsp70)は、腫瘍抗原ペプチドと結合性を有することに加え、Hspレセプターを介して抗原提示細胞(APC)に効率よく取り込まれること、されには細胞性免疫を賦活化することから、強力な抗原キャリア分子として注目されている(Fig.1)。1),2)
一般的な癌免疫法では、対外から癌抗原ペプチドが投与されるが、癌細胞内にはさまざまな癌抗原が存在することから、これらを利用することで抗腫瘍免疫が誘導可能であると考えられる。そのためには、癌細胞内の抗原を積極的に癌細胞外へ輸送し、APCにデリバリーすることが必要である。
通常、高分子の膜透過は大きく制限されるが、単純ヘルペスウィルス由来のVP22タンパク質など細胞膜透過性を示すペプチド・タンパク質の存在が報告されており、その利用によるHsp70-抗原ペプチド複合体の癌細胞外デリバリーの可能性が考えられる 3),4)。
そこで本研究では、細胞膜透過能を有するペプチド・タンパク質の機能を利用し、癌細胞内に導入・発現させたHsp70の癌細胞外輸送及びAPCデリバリーの可能性について検討した。
ヒトゲノムの解読が終了し、ターゲットとなる生体機能分子の構造に基づく医薬品開発が進められ、標的分子と特異的に相互作用する新規化合物の探索が行われている。これに加えて、疾患と関連するタンパク質や遺伝子などの生体高分子を直接患者に投与することによる疾患治療の可能性が飛躍的に高まってきた。しかしながら、これらの高分子化合物は細胞膜透過性が低いため、細胞内への移行が大幅に制限される。一方、ウイルス由来のペプチドが細胞膜に結合後細胞質内へ移行することが発見され、膜透過ペプチド(cell-penetrating peptide;CPP)と総称されるようになった。CPPをタンパク質やリポソームに結合することで、これら『積荷』を細胞内へデリバリー可能であることが報告されたことから、CPPを利用した高分子医薬の経細胞膜輸送による疾患治療の可能性が考えられる。また、単純ヘルペスの構造タンパク質VP22に代表される一部のCPPでは、細胞内から外への移行活性を持つことが示されており、これを利用した細胞内タンパク質・ペプチドの細胞外輸送が期待される。
熱などの刺激により発現が亢進するタンパク質群の一つである heat shock protein70(Hsp70)は、細胞内タンパク質の高次構造の形成や輸送、分解等を介助する分子シャペロンとして機能する。その一方で、Hsp70は抗原ペプチドと結合すること、hsp receptor を介してマクロファージや樹状細胞(DC)などの抗原提示細胞(APC)に取り込まれること、さらにはAPCを活性化するアジュバント能を有することから、腫瘍ワクチンとしての利用が期待される。そこで私は、Hsp70を骨格とする新規腫瘍ワクチンの開発を目的にマウスにおけるHsp70の体内動態について検討し、静脈内投与後主として肝細胞に発現するCD91の関与が大きいことを明らかにした。一方、皮下投与時には所属リンパ節への高い移行が明らかとなり、
Hsp70を利用するワクチン療法において効率的な免疫応答を期待する場合には皮下投与が有効な投与経路になりうる可能性を示した。
Hsp70を利用した腫瘍ワクチンの開発には、同定された抗原ペプチドのデリバリーシステムとしての利用が考えられ、抗原ペプチド融合Hsp70あるいはその発現プラスミドDNAを用いて現在その有用性の評価を進めている。一方、癌細胞内に存在する抗原ペプチドを細胞外に『引き出す』ことができれば、抗原の同定が不要になり、多くの癌種への適用が可能になるものと考えられる。
こうした背景のもと本研究では、Hsp70にVP22あるいはそのCPP部分を結合した融合タンパク質を設計し、これを発現するプラスミドDNAを腫瘍に直接投与することで、腫瘍内でのHsp融合タンパク質の発現と、それに引き続く抗原―Hsp融合タンパク質複合体の癌細胞外輸送による癌免疫治療の可能性について検討する。VP22ペプチドを用いた検討において本アプローチの有効性を証明したのちに、Hsp70融合タンパク質の効率的な細胞膜透過を実現するペプチドデザインを行い、癌免疫治療効果の増大を試みる。
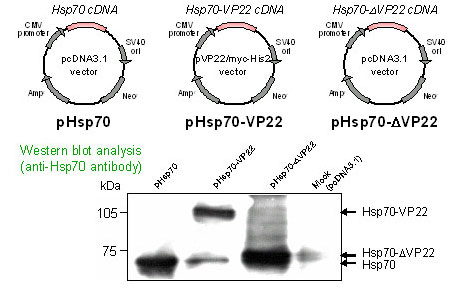
- Hsp70-ΔVP22の細胞外輸送
B16-F10細胞で発現したHsp70は、細胞質にほぼ均一に分布したが、Hsp70-ΔVP22は細胞膜近傍への局在が観察された(Fig.1)。
Confocal microscopic images of transiently expressed
Hsp70 fusion proteins in B16-F10 melanoma cells
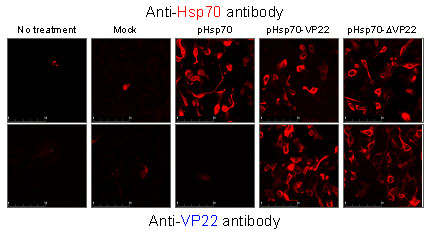
Fig.1 Intracellular localization of Hsp70 fusion proteins in B16-F10. B16-F10 cells cultured on coverslips were transfected with each pDNA, fixed, then permeabilized and stained with anti-Hsp70 antibody (top) or anti-VP22 antibody (bottom), followed by detection with Alexa Fluor 594-cojugated goat anti-mouse IgG. All images are of the same magnification.
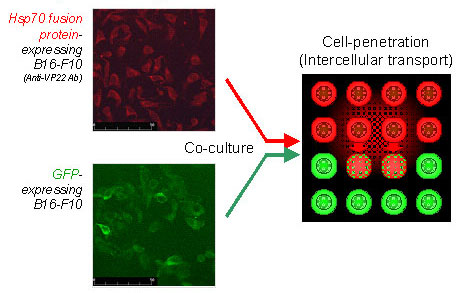
また、Hsp70-ΔVP22発現B16-F10細胞をGFP発現B16-F10細胞と共培養したところ、GFP陽性細胞においてもHsp70-ΔVP22が検出されたことから、VP22由来ペプチドを融合することにより癌細胞で発現させたHsp70を細胞外に輸送可能であることが示された(Fig.2)。
Validation of cell-penetration of Hsp70 fusion
proteins using stable clones of B16-F10 cells
Confocal microscopic images of Hsp70 fusion protein-
and GFP-expressing B16-F10 cells
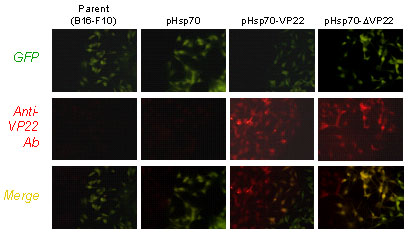
Fig.2 Extracellular spreading of Hsp70 fusion proteins in B16-F10. B16-F10 cells were transfected with pHsp70, pHsp70-VP22 or pHsp70-ΔVP22, washed, co-cultured with GFP-B16-F10 cells and imaged by immunofluorescence microscopy for VP22 and GFP signals. Merged image of a GFP-B16-F10 cell that has acquired Hsp70-ΔVP22 is shown in yellow.
- Hsp70-ΔVP22発現プラスミドDNAの腫瘍内投与による免疫応答の評価
pHsp70-ΔVP22投与群では、E.G7に対する高いCTL誘導活性ならびに抗体産生が認められた(Fig.3,4)。
CTL generation by immunization with Hsp70 fusion
protein-expressing plasmid DNA into E.G7 tumor
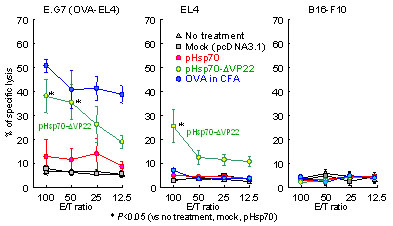
Fig.3 Tumor growth inhibitory effects by administration of plasmids. E.G7 was intradermally inoculated in C57BL/6 mice. When tumor volumes reached >40 mm3, pHsp70, pHsp70- ΔVP22, mock (100 µg/mouse) or OVA in CFA by intratumor injection by electroporation once a day for 4 days. Spleen cells were isolated and standard 51Cr release assay was performed. E.G7, EL4 and B16-F10 were used as target cells.
Production of anti-OVA IgG in serum of mice receiving
Hsp70 fusion protein-expressing plasmid DNA
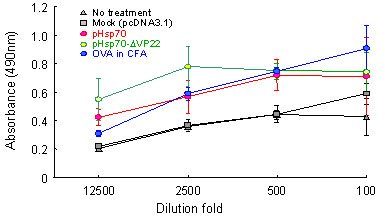
Fig.4 E.G7 tumor cells were intradermally inoculated in C57BL/6 mice. When tumor volumes reached >40 mm3, pHsp70, pHsp70- ΔVP22, (100 mg/mouse) or mock by intratumor injection by electroporation once a day for 4 days. 4 days after the last administration, the serum from mice was collected. Anti-OVA IgG was measured by ELISA. The results are expressed as the mean ± S.D.
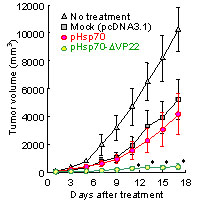
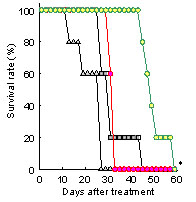
また、免疫応答の誘導に対して、pHsp70-ΔVP22投与群では腫瘍増殖の抑制ならびに生存日数の延長も認められた(Fig.5)。
Growth of E.G7 tumor after
intratumoral injection of
plasmid DNA in mice |
Survival rate of E.G7 tumor-
bearing mice after intratumoral
injection of plasmid DNA |
|
|
* P < 0.05 (vs no treatment,mock,pHsp70)
Fig.5 Tumor growth inhibitory effects by administration of plasmids. E.G7 was intradermally inoculated in C57BL/6 mice. When tumor volumes reached >40 mm3, pHsp70, pHsp70-ΔVP22 (100 µg/mouse) or mock by intratumor injection by electroporation once a day for 5 days. Tumor sizes and prolongation of survival time were measured every 2 days.
以上の結果から、細胞膜透過ペプチドを融合させたHsp70発現プラスミドDNAの腫瘍内投与により、癌細胞内の癌抗原ペプチドが細胞外へ輸送され、抗腫瘍免疫が誘導されることが推察された。
また、EL4に対してCTL活性が認められたことから、抗原性の強いOVAペプチドだけでなく、
EL4とE.G7に共通する別の癌細胞外に輸送されることが示唆された。