| TOP>融合研究コース 平成17年度 研究報告 | |
脂肪酸受容体GPR120のゲノム薬理学的解析ゲノム創薬科学分野 矢野 武明 研 究 指 導 主 任 : ゲノム創薬科学分野 教授 辻本 豪三 研究指導協力者:生体情報制御学分野 教授 中山 和久 研究内容要旨GPR120のリガンドである脂肪酸のカルボキシル基が受容体の細胞外ループに存在する塩基性アミノ酸残基と相互作用すると仮定し、これら4ヶ所のアミノ酸残基を点変異導入によりアラニンに置換した。作成した変異体をそれぞれHEK293細胞に一過性に発現させた後、リガンドであるα-リノレン酸刺激に伴うERKの活性化を測定した。その結果、第一細胞外ループに存在するR99A変異体のみにおいて顕著なERKのリン酸化抑制が確認された。その後、Tet-On システムによりドキシサイクリンで発現が誘導される安定発現細胞株を作成し、脂肪酸および天然物より抽出されたリガンドに対してERKのリン酸化と細胞内Ca2+の変動を測定した結果、脂肪酸のリガンドはR99A変異体において顕著なシグナルの抑制が認められた。一方、脂肪酸とは構造の異なる天然物より抽出されたリガンドにおいては、R99Aにおけるシグナルの抑制は認められなかった。以上の結果から、脂肪酸のリガンドはR99Aを介してGPR120と相互作用している事を明らかにした。 背景 G蛋白質共役型受容体(G-protein-coupled receptor;GPCR)は細胞情報伝達系において主要な仲介因子であり、疾病との関係も深く、創薬研究上重要な標的分子である。GPCR中にはリガンドが未知の、いわゆるオーファン受容体も多数含まれ、オーファン受容体のリガンド探索および機能解析は極めて重要である。当研究室では、このオーファン受容体の一つであったGPR120のリガンドが不飽和長鎖脂肪酸であることを明らかにした。GPR120は腸管特異的に発現しており、マウス由来の腸内分泌細胞STC-1にも発現している。STC-1細胞は遊離脂肪酸に反応しペプチドホルモンを遊離することが報告されており、遊離脂肪酸刺激による glucagons like peptide-1(GLP-1)の分泌が、GPR120を介していることが明らかとなった。申請者らによる先の報告においてSTC-1での遊離脂肪酸刺激によるアポトーシス抑制が 目的脂肪酸受容体GPR120刺激によるGLP-1分泌機構の全容を解明するため、リガンドと受容体の直接的な相互作用を証明すると同時に、受容体活性化からGLP-1の分泌までの経路を明らかにする。これにより、創薬標的分子としてのGPR120の生理学的な機能を明確なものとするとともに、創薬に結びつく包括的な情報を得ることを目指す。 方法リガンドと受容体の直接的な相互作用を証明するため、リガンドと受容体の結合様式の解析を行う。脂肪酸受容体群のアミノ酸配列アラインメントおよび立体構造のモデルからリガンドと相互作用する可能性の高いアミノ酸を選択し、変異導入を行うことでリガンド結合に必須のアミノ酸を同定する。次に、GLP-1の分泌機構を解明するため、GPR120の活性化によりGLP-1の分泌を起こすSTC-1細胞をモデルとし、シグナル伝達系に対する薬理学的ツールを用いた解析および、生化学的、分子生物学的な解析方法を用いてGLP-1分泌に関与する分子の同定を行い、情報伝達経路を明らかにする。さらにリガンド結合の低下した点変動導入型と野生型GPR120受容体とのシグナル伝達系の比較を、同定した分子種について詳細に検討することで、GPR120の活性化からGLP-1の分泌までの機構を明確にする。 結果
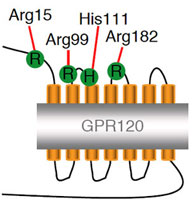 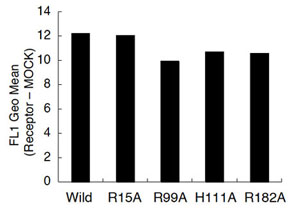 図1.塩基性アミノ酸残基の点変異導入および発現確認 脂肪酸との相互関係に重要であると予測した、細胞外ループに存在する塩基性アミノ酸残基をアラニンに置換した(左図)。FLAG融合GPR120を作製した。それぞれHEK293細胞に一過性に発現させ、フローサイトメトリー(FACS Calibur:BD社)にてFLAG抗体および蛍光標識プローブを用いて細胞膜表面に発現する受容体を測定した。縦軸は各受容体とMOCKにおけるGeo Meanの差分を示した。
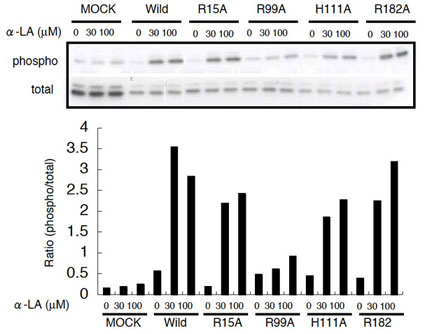
図2.HEK293細胞に発現させたGPR120および変異体のERK活性 野生型および、R15A,H111A,R182Aの各変異体をHEK293細胞に一過性に発現させた。それぞれ、α-LA を 0,30,100 µM にて 5 分間刺激したのち、pERKおよびERK抗体にて検出した。下段の棒グラフは上段の検出されたバンドを数値化したものを示した。
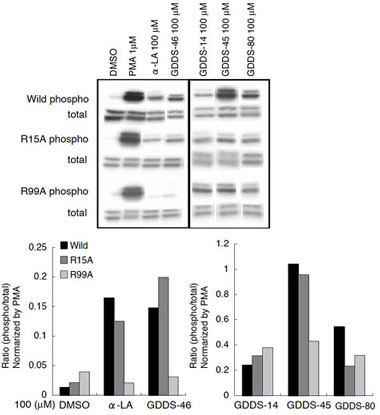
図3.安定発現細胞株におけるGPR120および変異体のERK活性 野生型および、R15A,R99Aの各変異体のドキシサイクリンにて発現を誘導できる安定発現細胞株(HEK)を作製した。それぞれ、ドキシサイクリンにて発現を誘導させた後、脂肪酸リガンドである α-LA およびGDDS-14、GDDS-45、GDDS-80 を 100 µM にて 5 分間刺激した。その後pERKおよびERK抗体にて検出した。 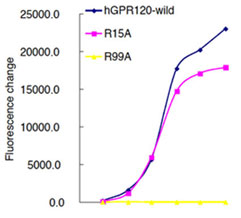 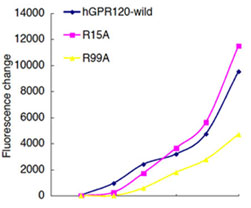 図4.安定発現細胞株におけるGPR120および変異体の細胞内Ca2+の変動 野生型および,R15A,R99A の各変異体のドキシサイクリンにて発現を誘導できる安定発現細胞株(HEK)を作製した。それぞれ、ドキシサイクリンにて発現を誘導させたのち、各濃度における α-LA (左図)およびGDDS-45(右図)にて刺激した。 以上の結果から、脂肪酸リガンドとGPR120の相互作用にはArg99 が重要であることを示唆した。一方、脂肪酸と構造の異なるリガンドに関しては、Arg99 を介さず相互作用すると考えられる。 期待される成果変位導入GPR120の解析により、受容体-リガンド間の直接的な相互作用を検証出来るはずである。さらにこの結果から、GPR120に対するリガンド結合の立体構造モデルの作成が可能となり、新規リガンドの探索へと役立つことが期待される。さらに、GLP-1分泌、制御機構の解析により、鍵となる情報伝達系と関連する分子種が明らかになるであろう。これにより、GPR120の腸管における生理的機能がさらに明確となり、薬物開発上、重要な情報が得られることが期待される。腸管から分泌されるGLP-1は、インスリン分泌の誘導及びグルカゴン分泌を抑制しすることから、GLP-1分泌、制御機構の分子レベルでの理解から、糖尿病、肥満、摂食調節に対する新たな治療標的分子発見の可能性もある。以上、本研究プロジェクトでは、広い研究分野の連携から、脂肪酸受容体GPR120のリガンド結合解析と、GLP-1分泌における機能解析とを包括的に行い、ゲノム創薬による新規の創薬標的分子の同定から、創薬応用へと発展する研究の達成が期待される。 |
|