3.膜タンパク質の構造形成原理の解明 |
|
|
|
膜中での静電相互作用は水中の約40倍強く、また疎水性相互作用が存在しないことから、膜タンパク質の構造形成原理は水溶性タンパクのそれと大きく異なっています。また、膜タンパク質のフォールディングを解明する上で重要になる点として、生体膜環境が多種多様な脂質分子から成り立っていることが挙げられます。 近年注目されている脂質マイクロドメイン(ラフト)のように、不均一でしかも動的変化をしうる多相系であることが生体膜の機能に重要であると考えられるようになってきました。タンパク質間の相互作用が新たなタンパク質?脂質間相互作用を生み、不均一ドメイン形成を誘起したり、逆にドメイン形成により他のタンパク質の局在が変化したりする可能性がありますが、脂質と膜タンパク質の織りなす相互作用に関する一般原理は全くといっていいほどわかっていません。 また膜厚などの膜物性の変化が膜タンパク質の活性に影響することがよく知られていますが、どのようなメカニズムでタンパク質の動的構造変化やそれに伴う機能に変化が起こるのか、多くは謎に包まれています。 |
|
|
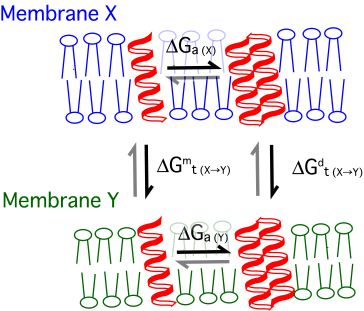
膜タンパク質の単離精製は一般に難しい上、水溶性タンパクと異なり、可逆に変性?リフォールディングさせることが難しいことを考えると、複雑な膜タンパク質そのものを用いてフォールディングを実験的に調べていくには多くの困難が伴います。また多数の相互作用部位を含む配列では、残基ごとの寄与を分離できません。 我々は、膜タンパク質の最小構成単位である膜貫通ヘリックスを形成するモデルペプチドを用いて、フォールディングに寄与する熱力学量を系統的に測定するアプローチを採っています。 これまでに、蛍光励起エネルギー移動法などを利用して、膜貫通へリックスの会合自由エネルギーや異なる膜間の分配自由エネルギーを計測可能な実験系を確立し、膜貫通へリックスの持つ基本的な性質を明らかにしてきました。へリックスのアミノ酸配列を変えることで膜環境での構造形成の駆動力を定量し、一方では脂質組成によるタンパク質間、タンパク質?脂質間相互作用の調節のメカニズムを解明したいと考えています。 特に近年、脂質リポソーム中に組み込んだ膜貫通ヘリックス間のsingle-pair蛍光エネルギー移動測定法を確立し、膜貫通ヘリックスが会合?解離する様子をリアルタイム測定しダイナミクスを詳細に研究することが可能になってきました。この新手法により、アミノ酸配列と脂質組成の変化、あるいはそれらの組み合わせによってヘリックス会合の安定性が大きく変化する例をいくつも見出しており、単純なモデル系においても、タンパク質と脂質による複雑な会合制御ルールの一端を再現できることが判明しつつあります。 |
|
【実験手法】 分光学(リポソーム調製、一分子蛍光イメージング、CD、FTIRなど) 熱測定 |