タイトル「Structure-based alteration of tryptophan residues of the multidrug transporter CmABCB1 to assess substrate binding using fluorescence spectroscopy」
論文はこちら
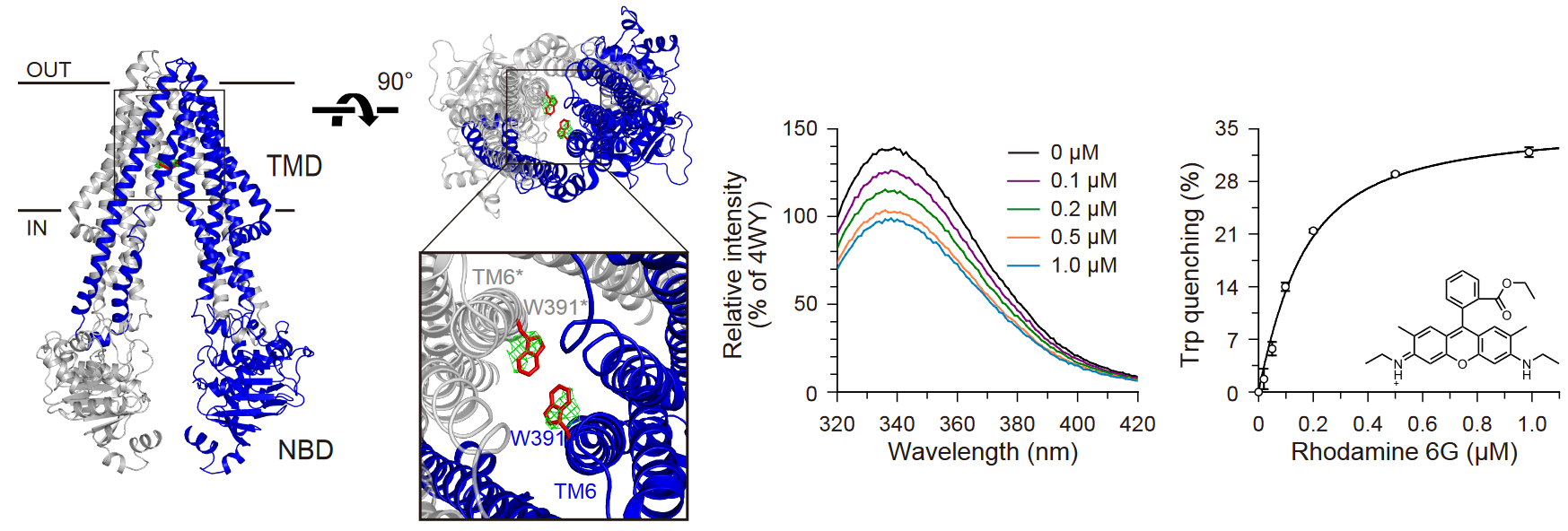
ABCB1はP糖タンパク質として知られ、ATPの加水分解と共役し疎水性化合物を細胞外へ能動輸送する輸送体です。多様な化学構造の薬物を認識・輸送し、がん化学療法での障害である多剤排出を行う実態でもあります。これまで当研究室はABCB1の立体構造研究を進め、ATP結合時に起こる構造変化や基質結合部位の特徴的な構造を明らかにしてきました。けれども、これまでABCB1に結合する基質の結合定数を正確に測定する方法が十分に確立されておらず、基質の結合と輸送との構造・機能相関の実態が不明なままでした。
本研究では、高度好熱菌であるCyanidioschyzon merolae由来のABCB1であるCmABCB1の基質結合部位のみにTrpを導入し、輸送基質の結合で蛍光が消失する部位特異的変異体の作成に成功しました。本変異体を用いて3種類の異なる輸送基質と1種類の阻害剤の結合定数の測定を行ったところ、各分子の結合を従来よりも遥かに高精度で推定することに成功しました。本研究で得られた新規測定系は、ヒト由来のABCB1の基質結合部位に結合する化合物の親和性測定への応用も可能で、今後の新規抗がん剤の開発へもつながる大きな成果です。