動脈硬化病態の病態解析
細胞膜上に発現するタンパク質(LOX-1、MT1-MMP、TF)を標的とした動脈硬化イメージング
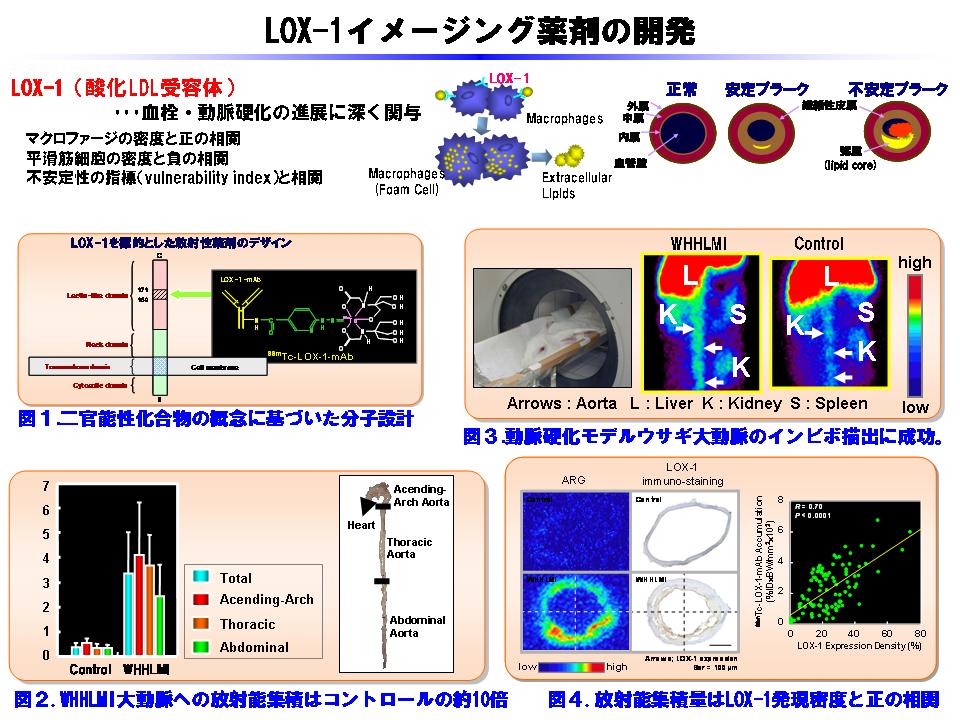
In vitroの検討において、酸化LDL受容体ファミリーの一つであるLectin-like oxidized LDL receptor-1 (LOX-1)は動脈硬化プラークの不安定化に多面的に関与することが示されていることから、不安定性動脈硬化プラークの核医学イメージングの標的としてLOX-1に着目し、動脈硬化ウサギを用いて不安定性動脈硬化プラーク部位でのLOX-1の発現状態を免疫組織化学的手法により検討した。その結果、LOX-1の発現は、MMP-9の発現、および、プラークの不安定性の指標と高い相関を示すとともに、線維性被膜の薄い動脈硬化プラークは厚いものと比較して有意に高いLOX-1発現を認めた。さらに、LOX-1は、血栓形成の原因となる組織因子と共局在を示したことから、LOX-1が不安定性動脈硬化プラークの核医学イメージングのための標的分子として有効であることが示された。
そこで、LOX-1を標的とする放射性分子プローブの開発を計画した。母体分子としては抗LOX-1抗体、放射性核種としては99mTcをそれぞれ選択し、二官能性キレート分子の概念の元に99mTc標識抗LOX-1抗体を設計、合成した(図1)。動脈硬化ウサギを用いた検討を行ったところ、99mTc標識抗LOX-1抗体投与24時間後の大動脈への集積は、正常ウサギに比べて約10倍高く(図2)、SPECTを用いた明瞭な大動脈の描出に成功した(図3)。さらに、動脈硬化ウサギ大動脈について組織学的検討を加えたところ、99mTc標識抗LOX-1抗体はLOX-1の発現に応じた分布を示す(図4)とともに、不安定性を示すアテローム性病変において最も高い放射能集積を示した。
以上より、99mTc標識抗LOX-1抗体は不安定性動脈硬化プラークの核医学質的診断に有効である可能性が示された。
動脈硬化プラークの不安定化の過程において、マトリックスメタロプロテアーゼ(MMP)によりプラークを覆う線維性被膜が脆弱化されることが知られている。このMMPファミリーの一つである細胞膜結合型MMP(MT1-MMP)は、プラークの不安定化に関与するとされているMMP-2を細胞膜上で活性化する酵素である。最近、ヒトの動脈硬化プラークにおいてこのMT1-MMPの発現が認められたことから、MT1-MMPが動脈硬化プラークの不安定化に深く関与している可能性が示唆されている。
そこで我々は、動脈硬化プラークにおけるMT1-MMPの発現と動脈硬化プラークの不安定性との関連について検討し、次いで、MT1-MMPを標的とした放射性分子プローブの開発に着手した。その結果、MT1-MMP発現密度は最も不安定なアテローム性病変において特異的に高く認められ、MT1-MMPは不安定性動脈硬化プラークイメージングの標的として有効であることが示された。放射性薬剤の母体分子としては抗MT1-MMP抗体を選択し、99mTc標識抗LOX-1抗体と同様の手法に基づき99mTc標識抗MT1-MMP抗体を設計・合成した。動脈硬化ウサギを用いた検討を行ったところ、99mTc標識抗MT1-MMP抗体は正常ウサギと比して動脈硬化ウサギ大動脈に約5.4倍高く集積し、SPECTによる明瞭な大動脈の描出に成功した。組織学的検討により、99mTc標識抗MT1-MMP抗体はMT1-MMP発現に応じた分布を示し、不安定性病変に特異的に集積したことから、99mTc標識抗MT1-MMP抗体により不安定性動脈硬化プラークを選択的に検出できる可能性が示された。
また、MT1-MMPはがんの浸潤・転移に密接に関与しがんの悪性度との相関が報告されていることから、我々は99mTc標識抗MT1-MMP抗体を用いたがんのインビボイメージングに関する検討も行っている。
組織因子(Tissue Factor, TF)は外因性血液凝固カスケードの開始因子であり、動脈硬化プラーク破綻に伴う血栓形成に関与している。すなわち、動脈硬化プラークの不安定化に伴ってプラーク内部に発現の増加したTFが、プラーク破綻により血液中の第VIIa因子と接触・反応することで血液凝固カスケードを開始し、血栓の形成に至る。当研究室においてもこれまでに、動脈硬化モデルウサギを用いた組織学的検討を行い、TFの発現が不安定性動脈硬化プラーク病変に選択的であることを示してきた。
そこで我々は、TFを標的とした放射性分子プローブを開発することを計画した。プローブの母体分子にはこれまで同様抗TF抗体の利用を考え、TF細胞外ドメインについてペプチド抗原性サーチを行った後、選択した配列をエピトープとした抗TFマウスモノクローナル抗体を得た。上記と同様の方法により99mTc標識抗TF抗体を設計・合成し、動脈硬化ウサギを用いた検討を行った。その結果、所期のとおり99mTc標識抗TF抗体は動脈硬化ウサギ大動脈に高く集積し、TF発現に応じた分布を示したことから、99mTc標識抗TF抗体により選択的に不安定性動脈硬化プラークを描出できる可能性が認められた。
主要論文
- Tissue factor detection for selectively discriminating unstable plaques in an atherosclerotic model rabbit.
J. Nucl. Med. 51 (12) 1979-1986 (2010) - Imaging with radiolabelled anti-membrane type 1 matrix metalloproteinase (MT1-MMP) antibody: potentials for characterizing atherosclerotic plaques.
Eur. J. Nucl. Med. Mol. Imaging 37 (11) 2093-2104 (2010) - Targeting of lectinlike oxidized low-density lipoprotein receptor 1 (LOX-1) with 99mTc-labeled anti-LOX-1 antibody: potential agent for imaging of vulnerable plaque.
J. Nucl. Med. 49 (10) 1677-1685 (2008) - Lectin-like oxidized LDL receptor-1 (LOX-1) expression is associated with atherosclerotic plaque instability–analysis in hypercholesterolemic rabbits.
Atherosclerosis 195 (1) 48-56 (2007)
アポトーシスを標的とした動脈硬化イメージング
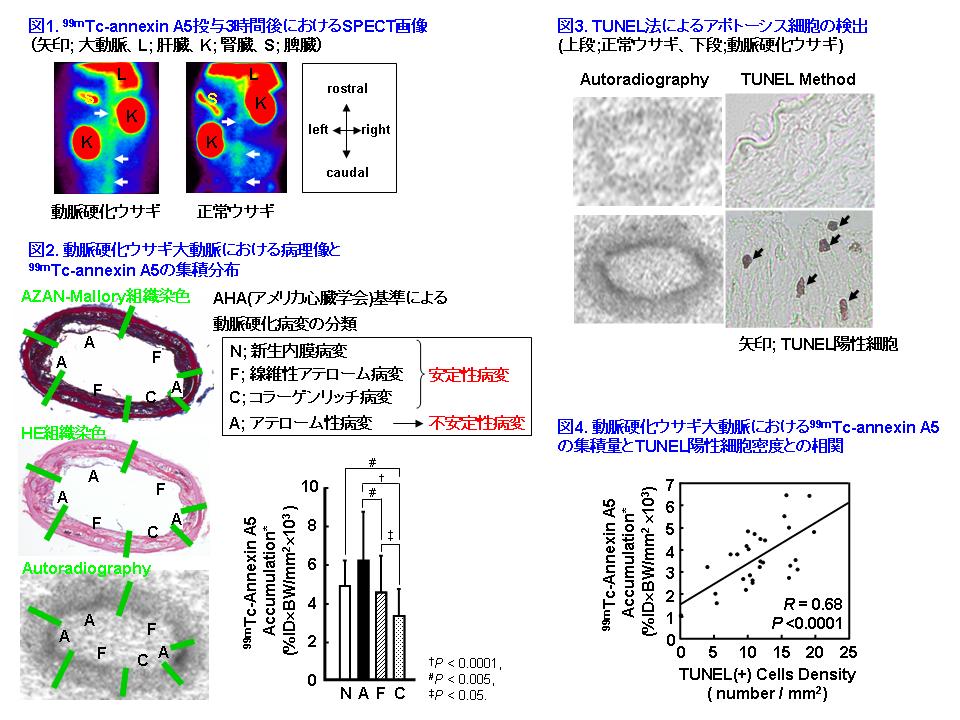
アポトーシスは、動脈硬化プラークにおいて、脂質コアの増大や線維性被膜の脆弱化に寄与している。したがって、アポトーシスのイメージングにより動脈硬化プラークの不安定性を評価できる可能性がある。一方、アポトーシスイメージング剤であるTc-99m標識Annexin A5(99mTc-annexin A5)は、動脈硬化イメージングへの応用も期待されている。そこで我々は、動脈硬化ウサギを用いて、99mTc-annexin A5の動脈硬化イメージングへの有効性を検証した。
その結果、99mTc-annexin A5投与3時間後の動脈硬化ウサギ大動脈への集積は、正常ウサギに比べて5.6倍高く、SPECTを用いた大動脈の描出にも成功した(図1)。そこで動脈硬化ウサギの大動脈について組織学的検討を加えたところ、99mTc-annexin A5の集積は、不安定な動脈硬化プラークを含む病変で最も高い値を示した(図2)。さらに動脈硬化ウサギではアポトーシス細胞を示すTUNEL陽性細胞が認められ(図3)、99mTc-annexin A5の集積はTUNEL陽性細胞の密度と有意な相関を示した(図4)。
したがって99mTc-annexin A5を用いてアポトーシスイメージングを行うことにより、不安定な動脈硬化プラークを選択的に検出できる可能性が示された。
主要論文
- 99mTc-Annexin A5 for noninvasive characterization of atherosclerotic lesions: imaging and histological studies in myocardial infarction-prone Watanabe heritable hyperlipidemic rabbits.
Eur. J. Nucl. Med. Mol. Imaging 34 (6) 889-899 (2007)
血管内不安定プラークのイメージング
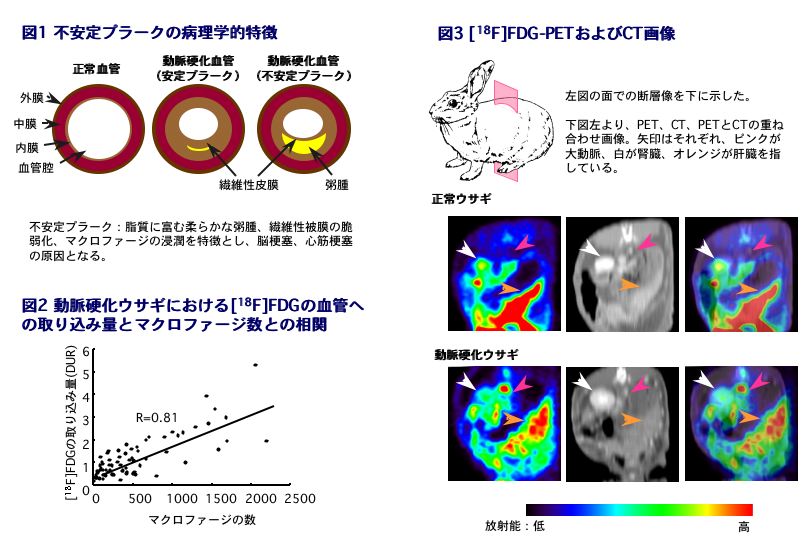
動脈硬化病巣に認められるプラークには、破綻しにくい安定なものと、破綻しやすい不安定なものとが存在する(図1)。不安定プラークは、プラークの破綻、血栓形成、血管内腔の狭窄・閉塞という一連の病態を引き起こし、脳梗塞や心筋梗塞の原因となる。一方、動脈硬化病変が進行しても安定プラークであればこのような病態を生じる可能性は少ない。したがって、不安定プラークを特異的に検出することにより梗塞性疾患発症を予測することが出来れば、適切な予防的治療を行うことが可能となる。
PET用糖代謝能測定薬剤である18F-フルオロデオキシグルコース([18F]FDG)により不安定なプラークを安定なプラークと区別し選択的に捉えることができるかどうか検討を行ったところ、[18F]FDGの動脈硬化ウサギ大動脈への取り込み量とマクロファージの数の間には良い相関関係が認められた(図2)。つまり、プラークへの[18F]FDGの取り込みには、プラーク不安定化に重要な役割を果たすことが知られているマクロファージの浸潤が大きな役割を果たしていることが判明した。さらに、CTおよびPET撮像を行ったところ、動脈硬化ウサギでは動脈硬化部位に高く放射能が集積し、[18F]FDGによるプラークの描出に成功した(図3)。したがって、[18F]FDG-PETによれば動脈硬化部位においてプラークの質的な違いを捉えることが可能であり、不安定プラークを選択的に画像化できることを見いだした。
主要論文
- Application of 18F-FDG PET for Monitoring the Therapeutic Effect of Antiinflammatory Drugs on Stabilization of Vulnerable Atherosclerotic Plaques.
J. Nucl. Med. 47 (11) 1845-1850 (2006) - 18F-FDG Accumulation in Atherosclerotic Plaques: Immunohistochemical andPET Imaging Study.
J. Nucl. Med. 45 (7) 1245-1250 (2004) - A catheter-based radiation detector for endovascular detection of atheromatous plaques.
Eur. J. Nucl. Med. Mol. Imaging 31 (9) 1299-1303 (2004)