- 教授 井垣 達吏
- 准教授 菅田 浩司
- 助教 榎本 将人
- 特定講師 谷口 喜一郎
- 特定助教 永田 理奈
研究紹介
近年、細胞の多様な振る舞いを分子レベルで説明できるようになってきました。しかし、 個々の細胞挙動がどのように相互連絡して「細胞集団としての機能」が生み出され、多細 胞生命システムが構築されるのか、その仕組みはほとんどわかっていません。当研究室で は、細胞同士の「競合」と「協調」という現象に着目し、その分子機構を解析することで、 器官発生や組織恒常性維持を支える細胞間コミュニケーションの基本原理、さらにはその 破綻によって起こるがんの発生・悪性化や老化の分子機構の解明を目指しています。
細胞間コミュニケーション機構を生体レベルで解明するために、その解析に最も効果的 なショウジョウバエをモデル生物として用いています。ショウジョウバエの大きなアドバ ンテージである遺伝学的解析、イメージング解析、および分子細胞生物学的解析技術を駆 使して、基礎生物学的な解析を進めます。さらに、共同研究を通じてショウジョウバエで 明らかになった基本原理を哺乳動物細胞やマウスの系に適用して解析し、その普遍性や多 様性を解明するとともに、ヒトのがんや老化を人為的に制御するための方法論の確立を目指します。
「細胞競合」の分子機構とその生理的役割に関する研究
近年、生態系で見られるような生物個体間の生存競争に類似した現象が、多細胞生物を構成する細胞間のレベルにも存在することが明らかとなり、「細胞競合」と名付けられました。細胞競合とは、同種の細胞間で相対的に「適応度」の高い細胞(勝者)が低い細胞(敗者)を積極的に集団から排除する現象です。細胞競合は、がんのもとになる変異細胞を排除することでがんの発生を抑制したり、生体内の不良細胞を除去することで老化を抑制したりするような役割をもつと考えられています。私たちの研究室では、ショウジョウバエを用いて様々な細胞競合のモデル系を確立し、細胞競合の分子機構とその生理的役割の解析を進めています。 細胞競合は、その役割や分子機構から「がん抑制型」「Minute型」「スーパーコンペティション」の3つのタイプに分けることができます。
「がん抑制型細胞競合」とは、細胞極性が崩壊したようながん原性の変異細胞が正常細胞に囲まれると細胞競合によって排除される現象です。 がんは様々な臓器の表面にある上皮細胞から生まれます。正常な上皮細胞は頂端-基底軸に沿った細胞極性(頂底極性)をもっていますが、この極性が崩壊すると細胞は増殖しやすくなりがん化が促進されます。例えば、ショウジョウバエの複眼原基(上皮組織)を構成する全ての細胞で極性遺伝子scribが変異することによって極性崩壊が起こると、細胞は過剰に増殖して巨大な腫瘍塊を形成します。興味深いことに、このscrib変異細胞は正常細胞に囲まれると腫瘍化せず、むしろ細胞死を起こして組織から排除されることがわかりました (Igaki et al. Dev Cell, 2009)。この現象は、現在では「がん抑制型細胞競合(tumor-suppressive cell competition)」と呼ばれています。がん抑制型細胞競合では、免疫細胞のように異物を排除するための特殊な能力をもった細胞が働くのではなく、いわゆる「普通の」細胞が近隣のがん細胞を認識して排除するという新しい現象です。この発見を起点として、ショウジョウバエの強力な遺伝学を応用して生体レベルでの解析を行い、がんを抑制するタイプの細胞競合は①正常細胞による極性崩壊細胞の貪食、②極性崩壊細胞に対する増殖抑制と細胞死の誘導、③極性崩壊細胞の組織からの排出、という3つの現象が協調的に進行することで駆動されることを明らかにしました(Ohsawa et al. Dev Cell, 2011, Vaughen and Igaki Dev Cell, 2016, Yamamoto et al. Nature, 2017など)。さらに、この細胞競合は隣接する細胞間の相互作用のみならず、離れた細胞や臓器間のシグナル伝達によっても制御されることを見いだしました(Katsukawa et al. Curr Biol, 2018, Sanaki et al. Dev Cell, 2020など)。極性崩壊によって駆動される細胞競合の細胞内シグナルの制御機構や、細胞競合を制御する臓器間のシグナル、さらにはこの現象の生理的役割を解き明かしていきたいと考えています。
「Minute型細胞競合」とは、MorataとRipollが1975年にショウジョウバエで最初に報告した細胞競合で、リボソームタンパク質遺伝子をヘテロに欠失した変異細胞(Minute変異細胞)が野生型細胞に囲まれると排除されるという現象です。のちに、ユビキチンリガーゼMahj/VprBP遺伝子やRNAヘリカーゼHel25E遺伝子の変異細胞も同様にMinute型細胞競合によって排除されることが明らかになりました。このタイプの細胞競合は、単独では普通に生存できる(一見、野生型細胞と全く区別がつかない)不良細胞が正常細胞と共存すると細胞死を起こして排除されるもので、組織中の細胞集団を最適化する役割を果たしていると考えられます。私たちの研究室では、このタイプの細胞競合において、不良細胞が正常細胞に近接するとオートファジー依存的な細胞死を引き起こして排除されることを見いだしました(Nagata et al, Dev Cell, 2019)。また、細胞競合の敗者となる不良細胞では、転写因子Xrp1の発現誘導を介して小胞体膜に局在するキナーゼPERKが翻訳開始因子eIF2をリン酸化し、これによりタンパク質合成がグローバルに低下して不良細胞が排除されることを見いだしました(Ochi et al, PLoS Genet, 2021)。細胞競合の敗者でどのようにしてXrp1が発現誘導されるのか、また勝者-敗者細胞間のタンパク質合成能の差がどのようにして敗者細胞のオートファジーや細胞死を誘導するのかはいまだ不明で、今後の重要な課題です。
「スーパーコンペティション」とは、がん遺伝子Mycを高発現する、あるいはがん抑制経路Hippo経路に変異をもつようながん原性の変異細胞が周囲の正常細胞に細胞死を誘導して組織を拡大していく細胞競合現象です。ヒトのがんにおいても、スーパーコンペティションによってがんの進展が起こると推測されています。私たちは、スーパーコンペティションにおいてがん原性細胞のタンパク質合成の上昇が周囲の正常細胞にオートファジー依存的な細胞死を誘導し、腫瘍形成を促進することを見いだしました(Nagata et al, Curr Biol, 2022)。さらに、このタンパク質合成の上昇はHippo経路の下流で発現誘導されるmicroRNAであるbantamによって引き起こされていることを見いだしました。bantamの発現上昇のみでスーパーコンペティションが起こることもわかりました。bantamがタンパク質合成を上昇させる機構、タンパク質合成の上昇が隣接する野生型細胞にオートファジーや細胞死を引き起こす機構は未だ不明であり、今後の重要な課題です。
当研究室では、これらの細胞競合に加えて、さまざまな遺伝子変異によって引き起こされる細胞競合現象を見いだしています。それらの細胞競合の分子機構を明らかにするとともに、細胞競合が正常発生やがん、老化をどのように制御するのか、その生理的役割や分子機構を明らかにしていきます。
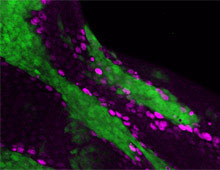
細胞間コミュニケーションを介したがんの発生・悪性化機構に関する研究
がんの発生や悪性化には、「がん遺伝子」や「がん抑制遺伝子」といった遺伝子変異の蓄積だけではなく、がん細胞を取り巻く微小環境が重要な役割を果たすことがわかっています。また近年のゲノム解析技術の進展により、がんは1種類の腫瘍細胞ではなく異なる遺伝子変異をもった複数の腫瘍細胞によって形成される「腫瘍内不均一性」と呼ばれる組織の状態を示すこともわかってきました。このような組織微小環境における細胞同士のコミュニケーションが、がん細胞の浸潤・転移能、治療抵抗性、再発に深く関わっていると考えられています。しかし、細胞間コミュニケーションによるがんの発生や進展の分子機構にはいまだ不明な点が多く、その仕組みはまだ良くわかっていません。
これまでに当研究室では、ショウジョウバエ腫瘍形成・悪性化モデルを確立し(Igaki et al, Curr Biol, 2006)、腫瘍細胞とその周囲の細胞とのコミュニケーションを介したがんの発生・悪性化機構の解析を進めてきました。例えば、がん遺伝子Rasの活性化とミトコンドリアの機能障害を同時に起こした変異細胞が炎症性サイトカインUpd(IL-6ホモログ)を産生・分泌し、その周辺の良性腫瘍をHippo経路依存的に悪性化することを明らかにしました(Ohsawa et al, Nature, 2012; Nakamura et al, Nat. Commun, 2014)。また、がん遺伝子Srcを活性化した変異細胞がHippo経路を介して周辺細胞の過剰な増殖を引き起すことを見いだしました(Enomoto and Igaki, EMBO Rep, 2013)。このSrcを活性化した変異細胞はRasを活性化した変異細胞と隣接すると、両細胞の境界上でNotchシグナルの活性化が起こり、これを起点としてRasとSrcを活性化した腫瘍細胞が共に悪性能を獲得することを明らかにしました(Enomoto et al, Dev Cell, 2021)。
一方で当研究室では、細胞同士の「協調」によるがんの発生・悪性化の基本原理の解明と並行して、これまでに私たちが確立したショウジョウバエ悪性化腫瘍モデルを用いて、がんの発生を抑制する分子機構の解明にも取り組んでいます。例えば、腫瘍細胞がアミノ酸トランスポーターJhI-21(Lat1ホモログ)を介してグルタミンを積極的に細胞内に取り込むことで悪性化している現象を発見し、この腫瘍をもつ個体にLat1活性を阻害する薬剤を作用させると腫瘍サイズが劇的に縮小することを明らかにしました(Bojie et al, PLoS Genet, 2021)。また、miR-306 とmiR-79と呼ばれる2種類のマイクロRNAはE3ユビキチンリガーゼRNF146を抑制しJNKシグナル依存的な細胞死を引き起こすことで腫瘍を組織から除去する作用があることを明らかにしました(Wang et al, eLife, 2022)。
これらのショウジョウバエ遺伝学を駆使した解析系を利用して、がんの発生や悪性化の分子機構について組織・個体レベルでの解明を目指しています。一方で、がんを制御する細胞間コミュニケーションが損傷組織の修復や再生にも貢献していることも見てきました。そこで細胞間コミュニケーションの視点から組織修復の仕組みを明らかにする研究も進めています。
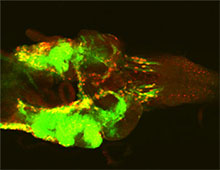
老化の分子機構に関する研究
個体老化とは、加齢に伴って生じる全身性の機能低下(組織・器官の老化)のことです。一見、個々の組織においてランダムに生じている様にみえる老化ですが、実は厳密な遺伝子制御のもとで進行する全身性プログラムであることがわかりつつあります。一方で、老化の速度やタイミングに個体差がある理由や、老化の進行がどのように開始するのかについてはほとんどわかっていません。近年の研究により、個体老化を引き起こす原因の一つとして、「細胞老化」と呼ばれる細胞変化が注目されています。細胞老化とは、テロメア短縮、DNA傷害、がん遺伝子の活性化といった異常に応答して、細胞周期を不可逆的に停止させる細胞応答です。
これまでに当研究室では、細胞老化やそれによって誘導されるSASP(Senescence-associated secretory phenotype)がショウジョウバエにおいても進化的に保存されていることを世界に先駆けて発見してきました(Ohsawa et al, Nature, 2012; Nakamura et al, Nat Commun, 2014)。さらに、細胞老化を誘導するのに必要十分な細胞老化のマスター制御因子として、Ets1/2転写因子のショウジョウバエホモログであるPointedを同定しました(Ito & Igaki, Sci Signal, 2021)。これら約10年にわたる細胞老化研究の成果として、ショウジョウバエ腸の特定の領域に、個体の加齢状態を監視し、個体老化をトリガーする「老化責任細胞」が存在することを発見することに成功しました(未発表)。ショウジョウバエ解析系のアドバンテージを生かして、この老化責任細胞が個体老化をどのように誘導するのかを理解すると共に、全身性の老化制御における組織間ネットワークを解明することを目指しています。さらに、京都大学iPS細胞研究所・小田裕香子研究室との共同研究により、マウスやiPS細胞も利用して、健康寿命延伸に向けた老化の人為的制御法の確立についても取り組んでいます。
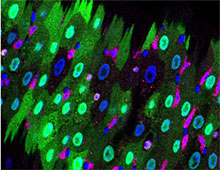
主要論文
- Nagata R, Akai N, Kondo S, Saito K, Ohsawa S and Igaki T
“Yorkie drives supercompetition by non-autonomous induction of autophagy via bantam microRNA in Drosophila”
Current Biology, 2022 Mar 14;32(5):1064-1076 [PubMed] - Ochi N, Nakamura M, Nagata R, Wakasa N, Nakano R and Igaki T
“Cell competition is driven by Xrp1-mediated phosphorylation of eukaryotic initiation factor 2α”
PLOS Genetics, 2021 Dec 6;17(12):e1009958 [PubMed] - Cong B, Nakamura M, Sando Y, Kondo T, Ohsawa S and Igaki T
“JNK and Yorkie drive tumor malignancy by inducing L-amino acid transporter 1 in Drosophila”
PLOS Genetics, 2021 Nov 15;17(11):e1009893 [PubMed] - Enomoto M, Takemoto D and Igaki T
“Interaction between Ras and Src clones causes interdependent tumor malignancy via Notch signaling in Drosophila”
Developmental Cell, 2021 Aug 9;56(15):2223-2236.e5. [PubMed] - Wada Y, Ohsawa S and Igaki T
“Yorkie ensures robust tissue growth in Drosophila ribosomal protein mutants”
Development, 2021 Jul 6;dev.198705.[PubMed] - Ito T and Igaki T
“Yorkie drives Ras-induced tumor progression by microRNA-mediated inhibition of cellular senescence”
Science Signaling, 2021 Jun 1;14(685), eaaz3578 [PubMed] - Akai N, Ohsawa S, Sando Y and Igaki T
“Epithelial cell turnover ensures robust coordination of tissue growth in Drosophila ribosomal protein mutants”
PLOS Genetics, 2021 Jan 28;17(1):e1009300 [PubMed] - Sanaki Y, Nagata R, Kizawa D, Léopold P and Igaki T
“Hyperinsulinemia drives epithelial tumorigenesis by abrogating cell competition”
Developmental Cell, 2020 May 18;53(4):379-389 [PubMed] - Nagata R, Nakamura M, Sanaki Y and Igaki T
“Cell competition is driven by autophagy”
Developmental Cell, 2019 Oct 7;51(1):99-112 [PubMed] - Katsukawa M, Ohsawa S, Zhang L, Yan Y and Igaki T
“Serpin Facilitates Tumor-Suppressive Cell Competition by Blocking Toll-Mediated Yki Activation in Drosophila”
Current Biology, 2018 May 15 [PubMed] - Cong B, Ohsawa S and Igaki T.
“JNK and Yorkie drive tumor progression by generating polyploid giant cells in Drosophila”
Oncogene, 2018 Mar 14 [PubMed] - Ohsawa S, Vaughen J and Igaki T
“Cell Extrusion: A Stress-Responsive Force for Good or Evil in Epithelial Homeostasis”
Developmental Cell, 2018 Feb 5;44 (3):284-296 [PubMed] (Review) - Vaughen J and Igaki T
“Breaking Down Neighbors to Fuel Tumorigenesis”
Developmental Cell, 2017 Feb 6;40 (3):219-220 [PubMed] (Review) - Yamamoto M, Ohsawa S, Kunimasa K and Igaki T
“The ligand Sas and its receptor PTP10D drive tumor-suppressive cell competition”
Nature, 2017 Feb 9;542 (7640):246-250 [PubMed] - Vaughen J and Igaki T
“Slit-Robo Repulsive Signaling Extrudes Tumorigenic Cells from Epithelia”
Developmental Cell, 2016 Dec 19;39 (6):683-695 [PubMed] - Nakamura M, Ohsawa S and Igaki T
“Mitochondrial defects trigger proliferation of neighbouring cells via a senescence-associated secretory phenotype in Drosophila”
Nature Communications, 2014 Oct27;5:5264 [PubMed] - Enomoto M and Igaki T
“Src controls tumorigenesis via JNK-dependent regulation of the Hippo pathway in Drosophila”
EMBO Reports, 2013 Jan;14(1):65-72 [PubMed] - Ohsawa S, Sato Y, Enomoto M, Nakamura M, Betsumiya A and Igaki T
“Mitochondrial defect drives non-autonomous tumor progression through Hippo signaling in Drosophila”
Nature, 2012 Oct 25;490(7421):547-51 [PubMed] - Ohsawa S, Sugimura K, Takino K, Xu T, Miyawaki A and Igaki T
“Elimination of oncogenic neighbors by JNK-mediated engulfment in Drosophila”
Developmental Cell, 2011 Mar 15;20(3):315-28 [PubMed]
